衰老进程中的一个最为明显的变化是基因突变明显增多,导致DNA损伤反应增强,从而激活DNA依赖的激酶(DNA dependent kinase, DNA-PK)。但DNA-PK影响老年期那些生理功能,与哪些病情相关一直来缺乏实验证据,目前的结果为最直接的结论。该研究发表在5月2日出版的“cell metab”上,由美国国立卫生研究院(NIH)等多家机构合作完成(Park SJ, et al. DNA-PK promotes the mitochondrial, metabolic, and physical decline that occurs during aging. Cell Metab. 2017; 25(5):1135-1146)。
老年期DNA-PK活性明显升高
为了让部分不愿意承认“衰老”、但承认“与年龄相关变化”的临床医生,更容易理解衰老的研究结果,今后,在部分结果的描述中,将使用“老年期”代替。另外,为了减少阅读时的网络流量,也将大幅度减少所附的相关图片。
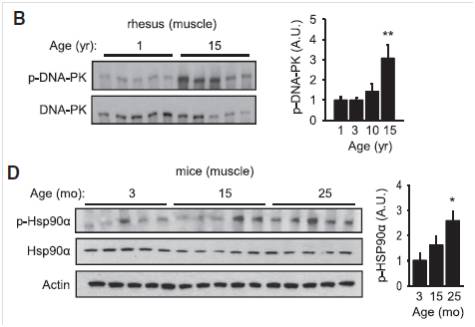
该研究选择了小鼠、大鼠和恒河猴动物模型。他们首次检测了随着动物年龄的增加,DNA损伤是否明显增加(以γH2AX的含量作为分子标志物),确实在老年恒河猴和小鼠中检测到γH2AX的含量明显升高。分析15岁的恒河猴的骨骼肌,发现磷酸化的DNA-PK明显升高(下图B)。DNA-PK磷酸化的底物之一分子伴侣Hsp90α,磷酸化水平也明显升高。检测15个月和25个月龄的小鼠也得到与恒河猴类似的结果。
需要注意的是肺中的Hsp90α磷酸化水平并没有升高,说明不同的衰老信号通路影响的器官是不同的。
DNA-PK影响的信号通路
DNA-PK通过Hsp90α的T5,7位点磷酸化,磷酸化的Hsp90α与多种激酶的结合发生解离,导致激酶的活化。例如:磷酸化的Hsp90α引起AMPK的激活,其磷酸化水平明显升高。免疫缺陷SCID小鼠是肿瘤和免疫研究的新型模型,该小鼠中的DNA-PK发生了无意义突变。对中年SCID小鼠的AMPK磷酸化水平检测发现,也明显增高。使用DNA-PK的抑制剂Nu7441或检测SCID小鼠,均可发现线粒体的含量明显升高。
使用DNA-PK的抑制剂还发现:可以降低高脂饮食小鼠的体重,降低血糖,具有抗糖尿病的作用。
饮食限制或有氧运动对DNA-PK磷酸化的影响
我们一直以来强调“饮食限制”而不用“膳食限制”,是因为目前有大量高糖、高营养的饮料。如果在限食时,不考虑饮料,仅是膳食(限制固体食物),是十分不全面和不科学的,尤其对多种饮料的主要消费者青少年更要注意。
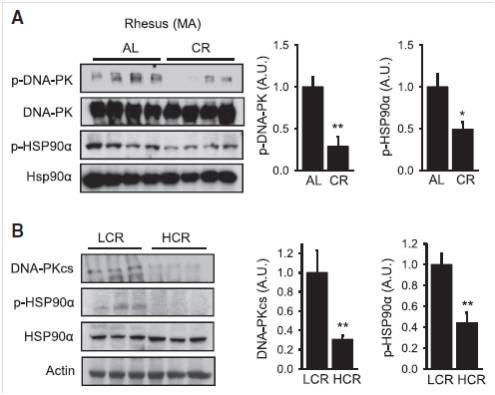
检测限制饮食限制(CR)3年多的恒河猴,发现其骨骼肌的DNA-PK、Hsp90α的磷酸化水平明显降低(下图A)。对跑步运动一段时间的大鼠,也检测到高强度跑步组(HCR)的DNA-PK、Hsp90α的磷酸化水平明显降低。
研究结果对老年病防治和健康的指导意义
-
新型的药物干预靶点 老年期的DNA-PK活性明显升高是导致肌肉衰老、肿瘤发生的重要原因。可以考虑建立模型,筛选抑制DNA-PK的药物,治疗相关的疾病。
-
研究骨骼肌衰老时,可以把DNA-PK作为衰老的生物标志物。
-
饮食限制和积极运动锻炼是低成本地改善健康、延长健康寿命的最佳途径,值得大力提倡和坚持。
“器官衰老专题”的延伸阅读
Cell:缺乏几丁质酶加速衰老引起的肺纤维化(原创)
原创│Cell子刊:长寿基因SIRT6的神经保护功能及其抗老年痴呆的机制
原创│Nature:肌少症可能与衰老降低肌肉干细胞再生能力有关


















