
在改革药品审评审批制度、解决药品审评积压的背景下.为使具有临床价值的新药和临床急需仿制药尽快上市,提高市场短缺药品的可及性,2016年2月26日,国家食品药品监督管理总局(CFDA)颁布了《关于解决药品注册申请积压实行优先审评审批的意见》(食药监药化管[2016]19号)。随后国家食品药品监督管理总局药品审评中心(以下简称药审中心)即把优先审评确立为重点建设的6项工作制度之一,正式设立优先审评通道,对纳入优先审评通道的品种优先调配审评资源加快审评,促进一批临床急需药品绕过审评积压得以快速上市(图1)。
本文介绍了我国优先审评制度的演变与确立过程,总结了我国优先审评工作进展,分析我国优先审评的特点与不足,并为后续如何进一步完善优先审评制度,建立常态审评下的优先审评常态机制进行了思考。
1 我国优先审评制度演变与确立
从特殊审批制度的提出到优先审评制度的确立,我国加快药品审评制度的逐级演变是与我国药品研发创新水平与临床需求进展相适应的¨ 。从早期重点强调鼓励创新,到提出临床价值与临床优势的要求,优先审评制度的确立过程逐渐提高了临床价值评价的权重,符合危重疾病患者的利益与药品审评审批制度改革的方向 。
2005年11月18日,CFDA颁布《药品特别审批程序》(局令第21号),对突发公共卫生事件应急处理所需药品临床试验、生产和进口等事项进行特别审批的程序。该程序是国家进入公共卫生应急状态时为保护公众健康生命安全对急需药品审评审批所设的特别加快通道,对审评审批、核查检验各环节时限都做了严苛限定(详见表1)。2007年7月颁布的《药品注册管理办法》(局令第28号)规定了特殊审批通道与适用范围,缩短其审评时限,同时对样品检验和标准复核也给予优先支持。随后,2009年1月CFDA颁布《新药注册特殊审批管理规定》,进一步细化了特殊审批申报及审评审批工作流程,加大特殊审批药品的沟通交流支持。特殊审批制度重点鼓励研究创制新药,从导向上更侧重鼓励研发新结构药物,而对临床价值导向强调不够,这与我国当时创新水平不高、创新机制落后的背景下,实施国家创新战略,大力推行激励创新政策有关。此外,新药特殊审批政策仅仅从审评时限上有一定的鼓励规定,未明确审评资源投入的要求,因此在近年出现的药品审评积压、审评超时成为常态的大背景下,也严重影响了该类药品的审评效率 。

2013年2月CFDA颁布《关于深化药品审评审批改革进一步鼓励药物创新的意见》,提出要加快创新药物、儿童用药审评,对临床急需、市场短缺的仿制药优先审评。这是第一次在总局发文中提出优先审评,也是第一次明确对创新药提出了临床价值的限定要求(表1)。
2015年8月国务院发布《关于改革药品医疗器械审评审批制度的意见》(国发[2015]44号)拉开了新一轮的药品审评审批改革帷幕,明确提出了加快临床急需创新药审评,加快4类药品的审批速度,为通过一致性评价的仿制药设立绿色通道。2015年11月,根据国发44号文精神,CFDA发布《关于药品注册审评审批若干政策的公告》,其中明确提出要制定和发布优先审评审批的有关政策,鼓励市场短缺和创新药品的研发和生产,将优先审评制度建设提上日程。2016年2月,CFDA正式发布实施《关于解决药品注册申请积压实行优先审评审批的意见》(食药监药化管(2016]19号),明确提出在当前存在审评积压情况下加快具有临床价值的新药和临床急需仿制药研发上市。意见共规定了可纳入优先审评的l7种情形,明确了优先审评的申请、审核、公示、纳入及审评审批的流程 ,对纳入优先审评品种加大从临床试验到上市申请全过程的沟通交流支持,同时要求对优先审评品种给予优先核查与优先检验支持。随后药审中心很快正式启动了优先审评通道,开始接受优先审评任务申请,并定期公示纳入优先审评通道的品种。2016年7月,药审中心在官网公布《“首仿”品种实行优先审评评定的基本原则》,即日起又把超过审评时限的首仿药也列为优先审评范围 。至此,我国共有18类药品被列为优先审评支持范围。
2 我国优先审评进展情况
2.1
优先审评申请与纳入数量
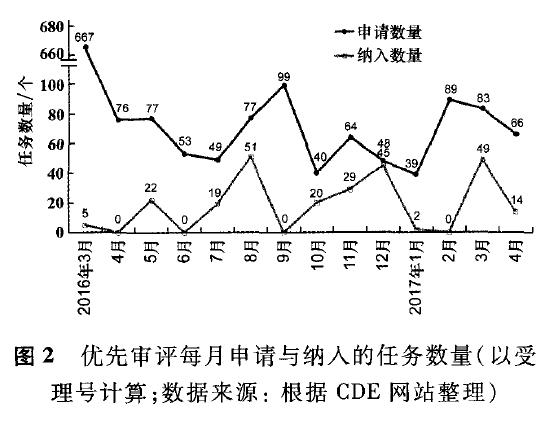
截至2017年4月底,药审中心已受理1 527件优先审评申请(未经特殊说明,本文所有任务数量均以受理号计),公示16批拟纳入优先审评审评任务,已有256件审评任务被确定纳入优先审评,平均每月纳入18个优先审评任务(图2)。
2.2
纳入优先审评任务总体概况
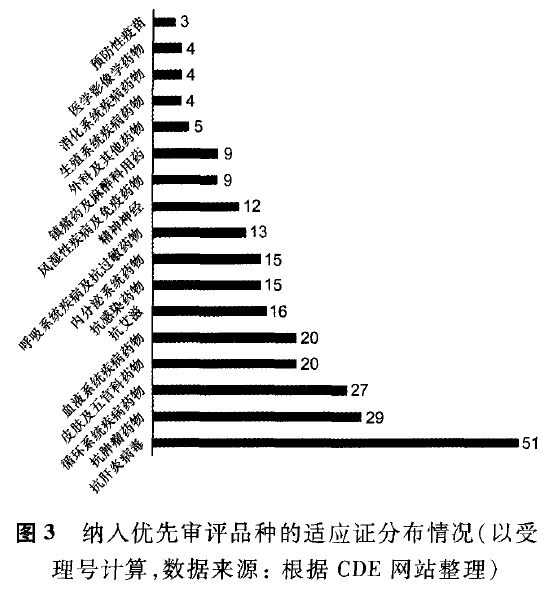
截至2017年4月底,已纳入优先审评的256个任务中,化药221个(86%),生物制品33个(12.9%),中药2个。国产药与进口药基本持平,分别为143个(56%)、113个(44%)。批准生产13个,批准进口24个,批准临床51个,批准补充8个,自主撤回6个,不批准2个。纳入优先审评品种的适应证分布情况见图3。
2.3
纳入优先审评任务完成情况
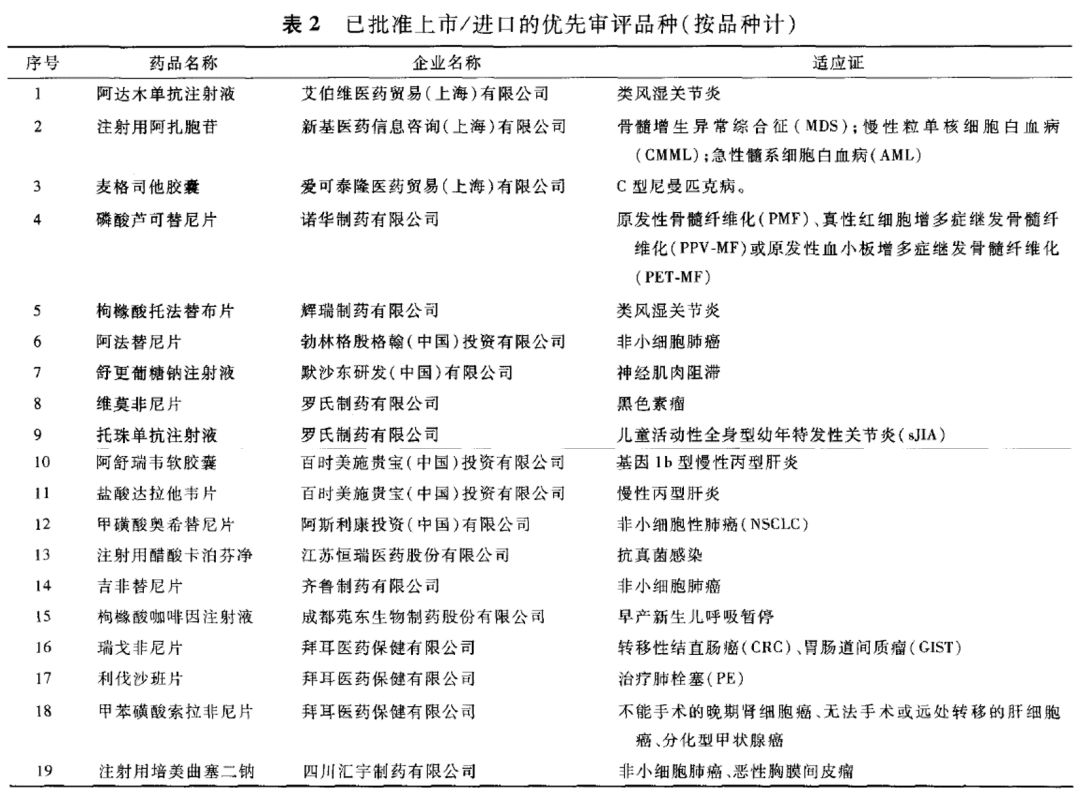
截至4月底,已纳入优先审评的任务共有104件任务已完成审评审批,共有19个优先审评品种获批上市或进口(表2)。未完成的152个优先审评任务中有56个已完成首轮审评,有20个等待企业发补资料,35个等待现场检查或样品检验报告。在未完成的优先审评任务中,仍有许多有临床价值的品种,如抗艾滋药、抗恶性肿瘤药、直接抗病毒药、儿童用药等。药审中心正在对优先审评品种加强项目管理,调配审评资源,优化审评流程,预计2017年将会有更多有临床价值的优先审评品种批准生产。
2.4
审评时限分析
我国对优先审评任务自纳入起可绕开积压排队直接启动审评,并优先调配审评资源,但对技术审评时限未做特别要求。目前纳入优先审评的任务均为药审中心已承接的任务,纳入优先审评时已在药审中心进入排队或审评,无法有效地与标准审评进行比较审评时限。我们把在首轮审评即完成技术审评的77个任务提取出来,对其纳入优先审评起至审评结束所用时限进行分析,仍呵看出药审中心对优先审评品种的支持力度。由于审评积压原因,这77个任务的总体平均时限均超过了法定时限,尤其审评积压严重的ANDA序列[1] 。自纳入优先审评通道起,ANDA,IND,NDA与验证性临床任务平均用时仅为49 El、29 El、66日与70 El,审评速度大为提高。补充申请任务平均用时47 Et,与同序列未纳入优先审评任务比,审评速度也有大幅提高。待药品审评积压解决,建立常态审评优先审评机制后,优先审评的申请、审核与纳入等流程将基本与药审中心受理、承办同步,届时可以预计优先审评在审评时限上的优势与标准审评相比将更加明显。见表3。

3 我国现行优先审评制度特点及与
美国FDA优先审评制度的对比
我国现行优先审评制度是在推进药品审评审批改革、解决药品审评积压的背景下确立实施的,有其自身的特点。
3.1
我国优先审评制度的特点
3.1.1适用范围宽,惠及创新药与仿制药
在当前审评积压状态下为能持续激发创新,推进仿制药一致性评价提高我国仿制药水平,提高具有临床价值药品的可及性,我国优先审评不但惠及创新药与治疗重大疾病领域的新药,还包括首仿药及按一致性评价新标准重新申报的仿制药。优先审评的适用范围与当前我国药品审评审批制度改革支持方向相一致。
3.1.2强调临床价值为重要评价标准
我国优先审评评价标准不只强调创新与特殊适应证,还对这些药品的临床价值、临床需求提出了要求。实际工作中,药审中心首先组织专家对申请优先审评的品种进行临床价值与临床需求评估。创新药、治疗重大疾病领域的药品必须具有临床价值、临床优势或能满足目前未被满足的临床需求才被考虑纳入优先审评。
3.1.3 绕过积压排队,优先配置审评资源
对优先审评品种的临床试验注册申请、新药生产注册申请及仿制药注册申请均在被列入优先审评之El起10日内启动技术审评,绕开了审评积压排队。药审中心把优先审评品种设为所有审评任务的第一优先级别,加强项目管理与内外部协调,按照注册申请转人药审中心的时间顺序优先配置资源进行审评。此外,药审中心还将优先审评品种名单及时发送核查机构与药品检验机构,通知优先安排现场核查与样品检验。
3.1.4加大沟通交流支持,指导临床试验
纳入优先审评的创新药临床试验申请在临床试验申报前、Ⅱ期临床结束后Ⅲ期临床开展前以及申报上市前,均可向药审中心申请沟通交流,药审中心于30 El内安排会议,并以会议纪要方式明确议定事项。对于治疗严重危及生命的疾病且尚无有效治疗手段、对解决临床需求具有重大意义的新药,申请人可随时提出沟通交流申请,药审中心10 El内安排会议交换意见。
3.1.5未对审评时限提出特别规定
优先审评制度是在解决药品注册申请积压的大背景下提出的,因此纳入优先审评品种从审评时限上的优势是可绕过积压排队直接进行审评,大大加快审评进程。从实际审评时限看,所有优先审评品种所用审评时限明显少于相同序列标准审评,基本上自纳入优先审评通道起2个月内能够完成技术审评,未能完成的多数是由于等待申请人补充资料、样品检验报告或核查报告等外部原因。
3.2
我国优先审评制度与美国FDA优先审评制度的比较
因为美国IND的审批时限只有30天,所以优先审评只限于NDA阶段。美国NDA优先审评制度实施较早。1992年根据《处方药付费法案》(PDU—FA),美国FDA为达到加快药品审查的目的,创建的审查时间两级系统(标准审评和优先审评)中,优先审评的周期为6个月,标准审评周期为10个月[6]。2016年FDA批准的22个新药中有15个(68%)被认定为优先审评 。在IND 阶段,美国FDA还有快速通道确定,突被性疗法确定和加快审批等项目以鼓励临床试验的快速完成。
与美国优先审评制度相比,我国优先审评出台于特殊改革背景下,实施时间短,尚有许多可完善的空间(详见表4)。我国优先审评适用范围更宽,除有临床价值的新药外,还纳入了临床急需的仿制药,这与我国与美国相比研发能力差距较大有关,提高临床用药可及性仍是目前我国医药行业的主要矛盾。申请人可于IND申请阶段提交优先审评申请,这是考虑到在颁布实施优先审评制度时我国仍然存在[ND申请任务积压,且我国IND审评法定时限较长。在回应时间方面,药审中心一般每月组织专家审核并公示拟纳入的优先审评品种,自提交优先审评申请30个自然El内可见公示结果,要快于FDA规定的60个自然El的回应时间。与美国相比我国对优先审评时限尚未有特别要求,虽从实际工作看我国优先审评任务自纳入优先审评起审评速度有快速提升,基本上自纳入优先审评通道起2个月内能够完成技术审评,但仍需确立统一的、合理的优先审评法定时限,以便有效约束审评速度、科学制定审评计划及保证优先审评时限的一致公平。

4 我国优先审评制度的挑战与思考
2017年10月总局办公厅发布的《药品注册管理办法(修订稿)》第九条提出“国家鼓励以临床价值为导向的药物研制,设立优先审评审批制度”体现了我国药监部门对优先审评制度的高度重视。目前我国解决积压已逐渐进入尾声,截止2017年4月底,积压量已由2015年积压高峰期的25 000件降至现在的7 500余件(这一数字包括首轮书面发补未补回的任务。未完成首轮审评的只有3 000余件)。随着2017年下半年解决积压逐渐完成,如何利用《药品注册管理办法》修订的契机为优先审评工作制度正式立法,建立常态审评下的常态工作机制仍面临着挑战。着眼于满足患者利益,激励药品研发创新,鼓励高水平仿制,加快审评审批质量与效率,笔者对优先审评制度从以下几个方面进行了思考。
4.1
进一步细化完善优先审评适用范围与分类标准
现行优先审评制度立足于解决审评积压背景,适用范围较宽,分类标准尚不清晰。在当前审评人员匮乏的现状下,多种创新药与仿制药以同一优先级别纳入同一优先审评通道易使优先审评任务本身产生新的积压,影响审评效率 。建议在逐渐实现常态审评的情况下,进一步细化优先审评适用范围与分类标准,分设新药与仿制药不同通道,实现以临床需求程度评价为依据的差异化管理,细化不同优先级别。
4.2
进一步限定提交时间
目前我国IND申请已基本消除积压实现按法定时限审评。2017年10月23日总局发布的《(药品管理办法)修正案(草案征求意见稿)》中明确药品监督管理部门应当自受理新药临床试验申请之日起60个工作日内决定是否同意开展临床试验表明未来临床试验申请审评将会进一步提速。因此可参照发达国家经验将优先审评资源集中在NDA申请。此外还可参考发达国家经验,对}台疗重大危重疾病、罕见病并可满足目前未被满足临床需求的药品上市申请,考虑建立滚动提交补充资料的机制,也可考虑在初步获得确证性安全性及有效性结果后批准有条件上市 。
4.3
进一步明确临床价值评价标准
目前我国对临床价值的评估标准尚不明确,对罕见病、疾病危重程度、临床需求程度等未有官方的一致评价标准,易引起优先审评筛选评价标准不统一技术认定标准,如疾病危重程度要根据临床量化指标与流行病学数据设定诸如死亡率统一量化标准;临床治疗优势要基于疗效与安全性来设定统一量化标准,如与现有治疗手段比能显著加快起效时间并能延迟有效时间的量化范围,或能降低疾病的发病率和死亡率的量化范围;尽快制定我国官方罕见病划分标准等。
4.4
加强各部门协调,优化审评审批流程
建立以审评为核心、检验与核查为支撑的药品审评审批体系为药品审评审批制度改革的重要任务之一。探索以优先审评品种为试点建立审评、核查、检验并联机制,合理统筹时间。审评机构内部也要不断优化审评,根据优先级别为优先审评设定具体优先审评时限。进一步打破专业领域藩篱,加强各专业融合,按照以主审报告人为核心的适应证团队模式进一步提高审评质量与效率。
4.5
协同推进各项审评工作制度
优先审评工作不是药品审评工作中孤立的一项工作,其涉及到内部审评资源有效配置及适应证团队密切配合,外部高效沟通交流协调及行业专家技术支持,其中任何一环出现短板都会影响优先审评的质量与效率。优先审评工作的顺利开展需要适应证团队、项目管理、沟通交流、专家咨询等各项审评工作制度协同推进。随着药审中心人员规模的扩大,在做好制度顶层设计的同时将逐渐有充足的人力整体推进落实并不断完善提高各项工作制度,在此基础上优先审评工作机制有望逐渐成熟完善,并可为标准审评树立典范提供经验,从而带动整体药品审评质量与效率的提升。
5 总结
优先审评制度的建立是现阶段我国药品审评审批制度改革工作的重要一环,为审评积压状态下加快具有临床价值品种审评审批发挥了重要作用。随着改革的深入、审评积压的基本消除,审评审批工作的主要矛盾也会发生转变。新形势下建立常态审评下的常态优先审评机制有利于持续激发提高我国药品研发创制水平,同时也有利于带动标准审评效率的提升,促进药品审评审批全系统工作流程的优化,整体带动我国药品审评审批水平的提高。

















