Triumvira Immunologics近日宣布发表在国际著名期刊《Nature Communications》上发表了一篇经过同行评审的文章。

名为“The chimeric TAC receptor co-opts the T cell receptor yielding robust anti-tumor activity without toxicity(嵌合TAC受体指派T细胞受体产生强效的抗肿瘤活性且无毒性)”:
描述了该公司特有的TAC(T细胞抗原偶联剂)技术的作用机制,对T细胞进行工程化设计使其能够特异性攻击血液肿瘤以及实体瘤。
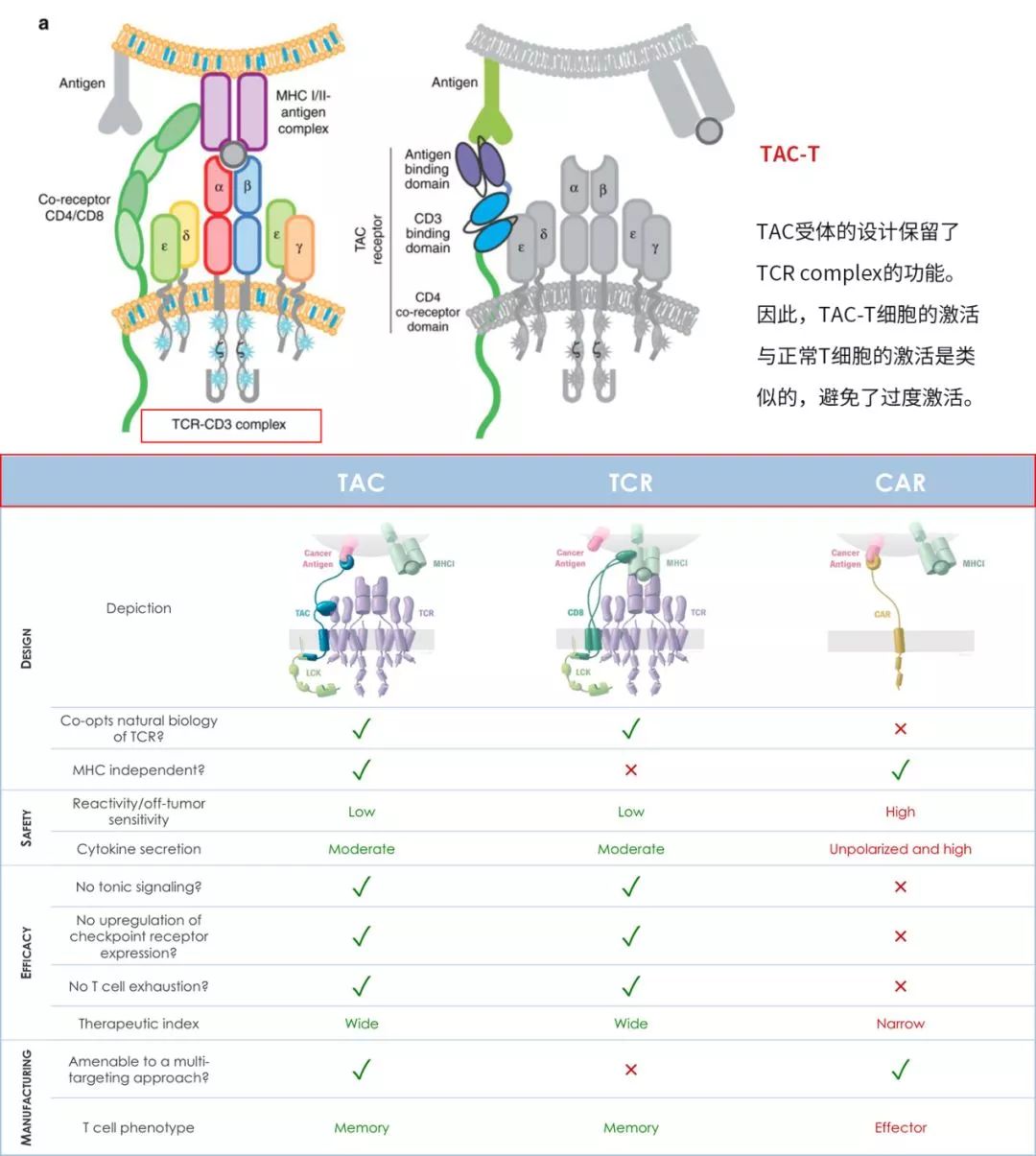
TAC-T、TCR-T和CAR-T的差异(图片来源 Triumvira)
优于二代CAR
针对实体瘤安全有效
临床前研究结果清晰的表明:这种针对多种抗原的TAC技术改造的人T细胞能够在体外产生强效抗原特异性的细胞因子以及细胞毒性,并且在各种异种移植物模型(包括实体瘤和血液肿瘤)中的强抗肿瘤活性。
此外,该研究还观察到了HER2-TAC T细胞在实体瘤中表现出的强烈浸润以及局部增殖和活化。

在卵巢癌和急性粒性白血病小鼠模型中,TAC-T细胞疗法显示出强抗肿瘤活性(图片来源 nature)
Triumvira的联合创始人兼代理首席科学官Jonathan Bramson博士表示:“实体瘤模型中的比较研究证明了TAC和CAR受体的独特生物学差异,与已知的CAR-T细胞治疗毒性不同,本研究表明TAC-T细胞优于第二代CAR-T细胞,显示出了更强的肿瘤穿透能力和抗肿瘤效力,以及更低的毒性作用。”
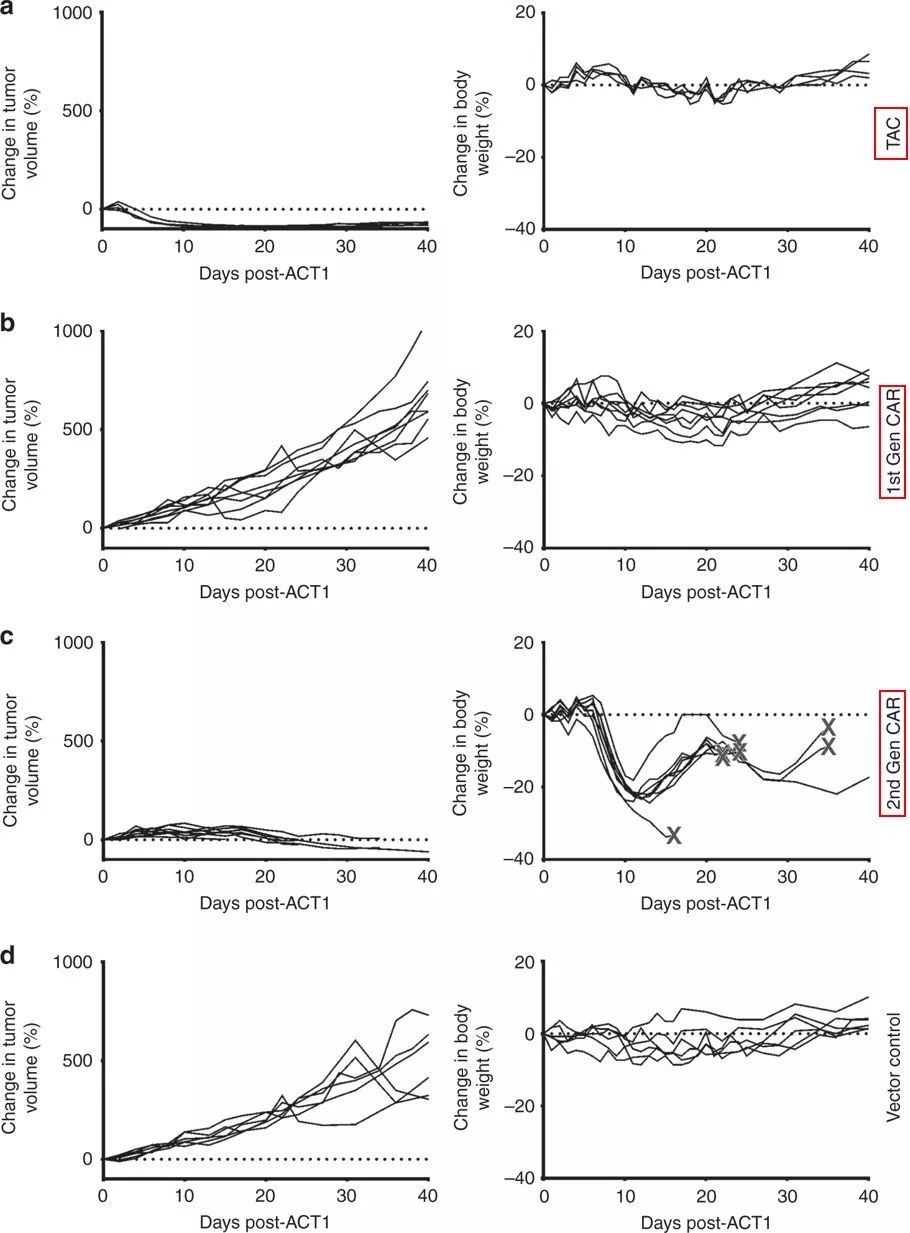
在卵巢癌小鼠模型中,HER2-TAC-T细胞表现出比第一代和第二代HER2-CAR-T细胞更强的安全性和有效性(图片来源 nature)
这些结果是相当令人兴奋的,表明TAC-T细胞相对于CAR -T细胞可能具有更高的治疗指数。
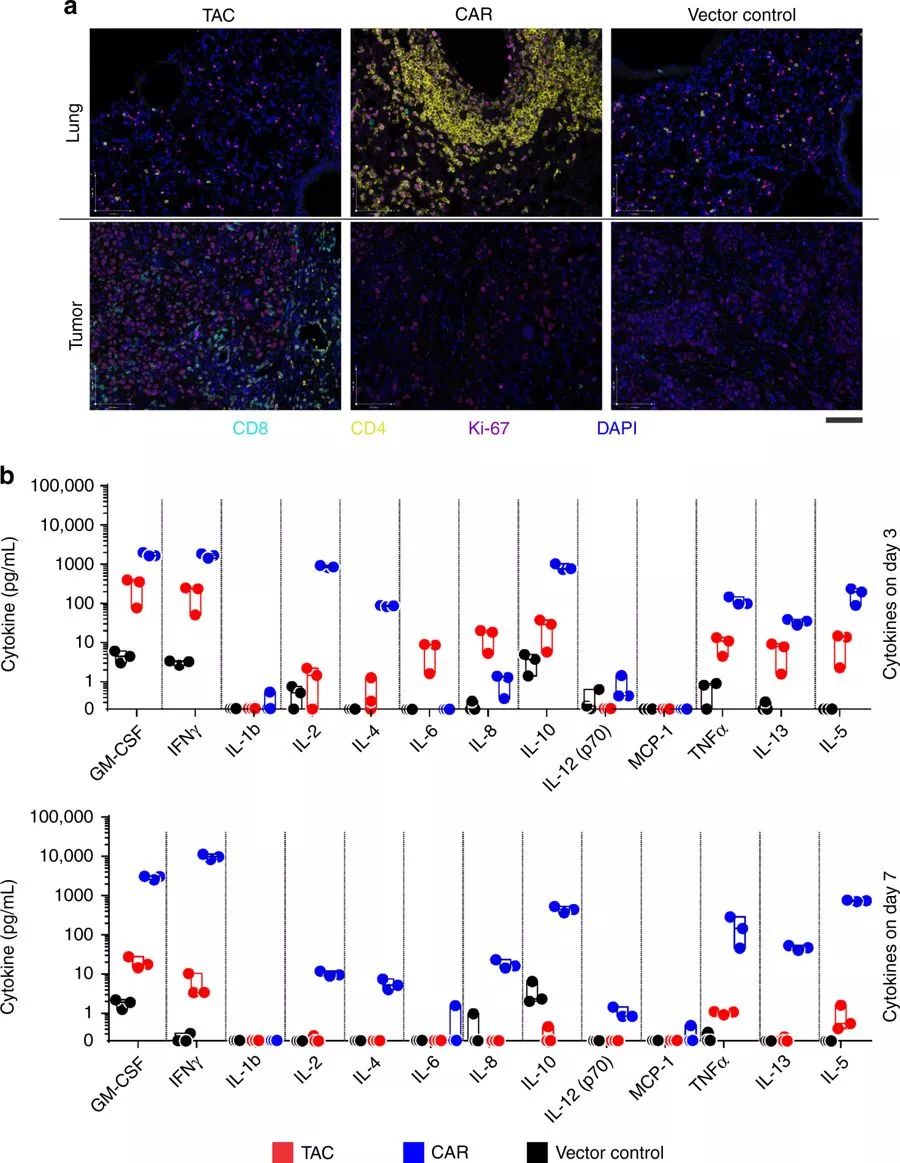
TAC-T细胞显示出比CAR-T细胞更强的肿瘤穿透性,未显示在肺、心脏或任何其他组织内的活化或扩增的证据(图片来源 nature)
对此,Triumvira 公司的总裁兼CEO Paul Lammers博士评论道:“这篇经过同行评审的文章为我们的TAC技术平台提供了科学验证,更具潜力、更容易被广大癌症患者所接受的T细胞疗法提供了未来的希望。基于这项研究和其他临床前数据,我们有信心继续将该计划推进临床开发。”
Triumvira的TAC技术平台

Triumvira Immunologics由加拿大麦克马斯特大学的Jonathan Bramson博士和Bloom Burton&Co于2015年共同创立,旨在开发出更安全,比目前的细胞疗法癌症治疗(包括CAR-T和TCR-T)更有效的新型T细胞疗法。
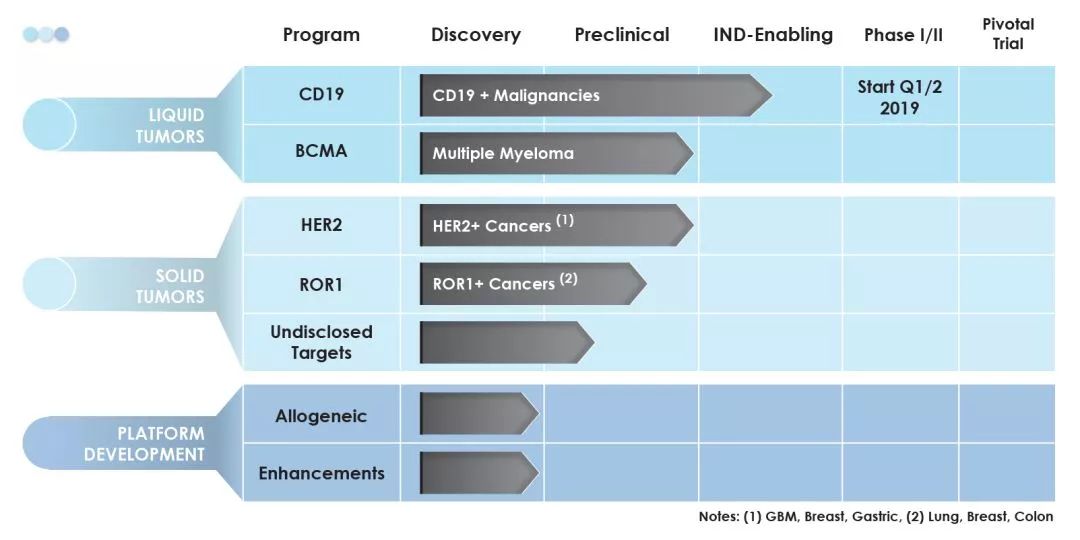
基于TAC技术平台开发的多项T细胞治疗候选产品(图片来源 Triumvira)
公司专有的TAC(T细胞抗原偶联剂)技术可以培养出完整的天然T细胞受体,并且不依赖于主要组织相容性复合物(MHC),可以为更广泛的实体瘤和恶性血液肿瘤患者开发更好的治疗方法(TAC –T细胞治疗的过程与常规CAR-T类似)。
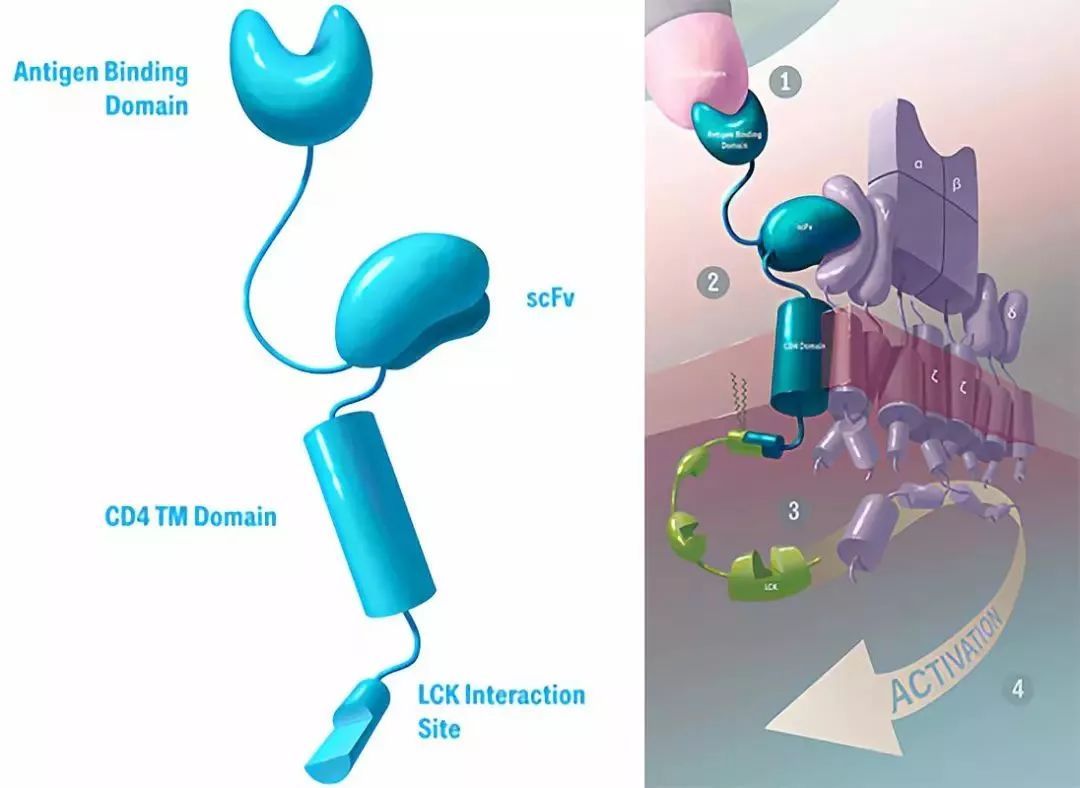
TAC结构(图片来源 Triumvira)
TAC的设计包含三部分:第一部分为胞外的抗原结合域(抗体片段或者DARPin等)、第二部分为胞外的anti-CD3 scFv、第三部分为跨膜的CD4 domain连接蛋白激酶LCK。
总体设计更类似于TCR,受体改造的结果是对T细胞的激活保持在正常的范围。
从上图中,我们可以看出TAC是包含多个蛋白质结构域的杂合分子,其将肿瘤靶向能力与T细胞自身的激活机制相结合。一旦整合到患者自身的T细胞中,其中一个结构域便通过结合肿瘤特异性靶标促进TAC-T细胞对肿瘤细胞的识别,第二个结构域将TAC分子连接到内源性天然T细胞受体(TCR),TAC分子通过CD4共受体结构域被固定在细胞膜上,这为TAC增加了共受体功能。
TAC通过肿瘤靶标和TCR结合能力以及共受体整合的组合,导致TCR信号传导途径的天然活化,从而导致T细胞介导的肿瘤细胞杀伤。
因为TAC本身不具有任何信号传导能力,所以T细胞活化仅由内源性天然TCR介导。因此,TAC利用完整的T细胞抗癌潜力,同时保留细胞的自然控制和安全机制。目前,基于该技术平台的自体细胞疗法正在开发中,但其同时也具有同种异体(off the shelf)应用的潜力。
参考出处:
https://www.nature.com/articles/s41467-018-05395-y
https://triumvira.com/press-releases/nature-communications-publishes-studies-comparing-triumviras-t-cell-antigen-coupler-tac-technology-with-car-t-cell-therapy/
来

















