Source of image:MSKCC
见惯了生死,人也会变得麻木,大概人们对于医生总会产生这样的误解。但在革命性的疗法出现的时候,没有人会比他们更激动。
63位患有B细胞急性淋巴细胞白血病并且没有其他治疗选择的儿童,他们的生存几率已经非常低。但大约83%的患者在接受了一种新的药物治疗后,三个月的时间内便出现了完全缓解,医生已经无法在这些病人的血液中找到任何疾病的踪迹。
这种药物正是Kymriah。去年八月,在经历了将近三十年的发展之后,首款CAR-T药物终于获得了FDA的批准。
这些都是已经无药可医的患者,他们在使用了CAR-T药物治疗之后病情快速恢复,即使是医生也会觉得难以置信。去年七月,当FDA外部评审投票一致建议Kymriah上市的时候,一位评审委员说这是他这辈子见过的最激动人心的事情。
兴奋的不仅仅是医生和病人,在Kymriah获批之后制药公司和投资人对CAR-T领域也变得狂热起来。
也就是在Kymriah获批上市的那个月,吉利德以119亿美元的价格收购了Kite Pharma,很快Kite的CAR-T产品Yescarta也获得了FDA的批准。
在这之后,新基以90亿美元的价格收购了Juno therapeutics。与此同时,无数的投资机构也开始将大把的钞票洒向了从事新一代CAR-T疗法开发的生物技术公司。
截至目前只有Kymriah以及 Yescarta这两款CAR-T疗法获批上市。目前获批适应症对应的病人群体并不大,而且由于CAR-T疗法是一种高度个体化的疗法,其价格非常昂贵,Kymriah的单次治疗价格为47.5万美元,因此获批上市之后接受过这两款药物治疗的患者并不多。
与此同时,接受治疗的患者也有可能出现严重的毒性反应,比如细胞因子释放风暴以及脑水肿。在临床试验中曾多次出现病人因毒性反应而死亡的案例,因此该项疗法通常只适用于病人的末线治疗。
目前CAR-T疗法在实体瘤治疗领域的研究进展并不大,而且如果将CAR-T疗法扩展至实体瘤的治疗,毒性反应的控制将会面临更大的挑战。
因此目前无论是医生,制药公司还是投资人对于CAR-T疗法未来的预期已经开始变得比较谨慎。
血液瘤的成功,必然还是偶然?
记得有一次在听会议报告的时候,一位小朋友说CD19是上帝的恩赐。确实如此,CD19的确是CAR-T治疗的一个极为优秀的靶点。
从下图中可以很明显的看到,CD19广泛存在于B细胞的表面,从Pre B到成熟B细胞的整个阶段,在相应B细胞的表面都能够发现CD19的踪迹。
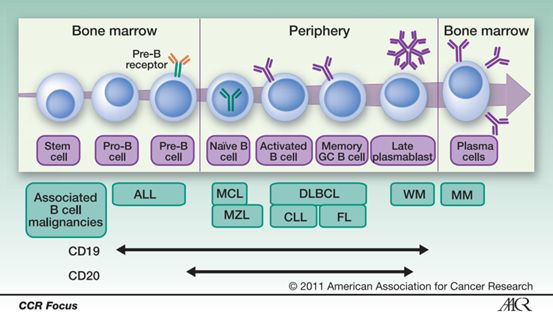
靶向CD19的CAR-T细胞能够清除表达这一抗原的B细胞:无论是健康的B细胞,还是导致白血病或者淋巴瘤的B细胞,CAR-T细胞都能够极为高效地将其清除。
所以很明显,这些CAR-T细胞的攻击并不具有肿瘤特异性,因为这些CAR-T细胞对于正常的B细胞也同样会产生伤害。
但该疗法成功的关键在于,即使清除了病人体内的B细胞,通常也不会对病人的健康产生严重影响。因为病人可以通过输入免疫球蛋白来补偿正常B细胞损伤所产生的影响,因此清除正常B细胞的风险是可控的
CAR-T疗法对于靶点的要求极为严格,对CAR-T靶点的要求为:
1 表达于细胞表面。
2 该靶点不能在除肿瘤外的、重要的器官或者细胞类型(比如造血干细胞)上出现,即使低水平的表达也有可能引起严重的副作用。
3 为了避免抗原逃逸,所有的肿瘤细胞都必须表达该抗原。即使该抗原无法在所有肿瘤细胞表面表达,也必须对维持tumorigenic phenotype具有至关重要的作用。
第一条很容易理解,这是由于CAR-T细胞MHC非依赖性的特性决定的。第二条对于控制CAR-T细胞的毒性至关重要,稍后在实体瘤进展的部分将详细讲解。因为CAR-T细胞的敏感度非常高,即使是低水平的抗原表达也能够引发T细胞对相应细胞进行攻击。第三条对于保证CAR-T疗法的有效性至关重要。
很明显CD19能够满足以上三条要求。而且除了CD19,B细胞表面的其他一些抗原也同样能够满足以上特性,比如BCMA。
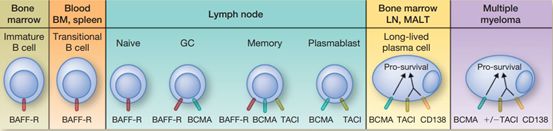
BCMA表达
BCMA同样也是一个非常优秀的CAR-T治疗靶点。虽然目前尚无相关产品获批上市,但在临床试验中,靶向BCMA的CAR-T疗法用于多发性骨髓瘤的治疗已经获得了很大的成功。
控制毒性反应
尽管靶向CD19以及BCMA的CAR-T疗法已经获得了很大的成功,但毒性反应依然是很大的障碍。
虽然Kymriah以及 Yescarta顺利获批上市,但不是所有的制药公司都像诺华以及Kite这么幸运。
2016年3月,Juno Therapeutics因为II期临床试验中五名病人因脑水肿死亡而停止了相关临床试验。这种严重的脑水肿是CAR-T疗法研究的主要的阴霾之一。直到现在科研人员对于脑水肿的具体形成机制都不是十分清楚。
而脑水肿也不是CAR-T疗法唯一的毒性反应,回输的高活性CAR-T细胞有可能导致其他严重的后果。在2015年诺华进行的临床试验中,大约一半的病人出现了严重的炎症反应:细胞因子释放综合征(cytokinerelease syndrome,或者叫做细胞因子风暴 cytokinestorm)。我们现在已经知道这是CAR-T疗法的常见副作用。
CAR-T细胞由于是活的药物,与传统的药物有着非常大的区别。CAR-T细胞被抗原活化之后能够进行指数级的扩增,而CAR-T细胞在对肿瘤细胞发动攻击时也同时会释放细胞因子,从而促进炎症反应,募集更多的免疫细胞。如果这些CAR-T细胞进攻过于迅速的时候,就有可能引发致命的细胞因子释放风暴。
目前来看,细胞因子释放风暴一般是可控的,医生可以通过使用tocilizumab等药物对该反应进行控制。但在极端情况下,及时快速地清除引发毒性反应的CAR-T细胞将有可能控制严重的毒性反应。
而使用自杀开关(suicide switch)来控制CAR-T细胞会是一个比较好的选择,在出现严重毒性反应时可以通过控制CAR-T细胞上的自杀开关来快速诱导CAR-T细胞凋亡,避免毒副作用进一步恶化。
学术机构以及生物技术公司的科研人员设计的自杀开关多种多样,目前已经有一些应用自杀开关的CAR-T疗法进入临床前/临床研究。
Bellicum Pharmaceuticals开发的CAR-T疗法中的使用的安全开关具有两个工程化蛋白,在结合小分子药物rimiducid之后该蛋白能够二聚并活化caspase-9,并最终诱发CAR-T细胞凋亡。
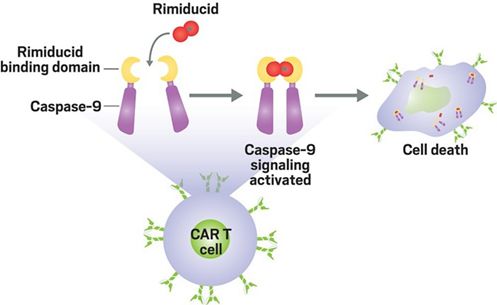
Bellicum已于近期启动了GoCAR-T 产品BPX-601 的I期临床试验。另一家生物技术公司Poseida Therapeutics也在使用rimiducid激活的CAR-T自杀开关。
除了通过小分子来控制开关,自杀开关也可以使用抗体来控制。Cellectis使用的CAR-T细胞能够结合利妥昔单抗,CAR-T细胞在被利妥昔单抗结合之后有可能被正常的免疫细胞识别并将相应的CAR-T细胞清除。
通过小分子控制的自杀开关有可能在数小时内清除CAR-T细胞,而这种通过利妥昔单抗标记的CAR-T细胞则需要数天的时间才有可能被清除,这其实也是该类开关的一个很大的缺陷。
目前还不知道这些自杀开关是否能够有效的控制严重的毒性反应,而且现在很多人并不认为自杀开关是必须的。
通用性CAR-T
除了这些生物学上的难题,CAR-T疗法还面临着时间与金钱的问题。化疗之所以能够在肿瘤治疗中广泛应用,不仅是因为能够减缓或者阻止肿瘤的进展,还因为这些药物可及性比较高,价格相对低廉,并且可以大批量的制备,运输和存储。
而CAR-T疗法却与之相反,特别是CAR-T细胞在制备的过程中需要病人在医院将血液中的免疫细胞分离出来,冷冻(有一些产品制备过程不需要冷冻)并且将这些细胞转运至CAR-T工厂,解冻之后使用病毒载体导入基因,冷冻,之后再运回医院,解冻,最后在回输至病人体内。
以诺华的药物为例,这个过程大概需要22天。考虑到这个过程的复杂性和时间的紧迫性,诺华为其药物定价为单次治疗47万5千美元。
除此之外,很多晚期患者很难进行T细胞采集,而且对于婴儿以及年龄较小的儿童来说,提取足够量的T细胞是比较困难的,这也就使他们无法完成CAR-T疗法的第一步。
如果CAR-T疗法真的想与化疗药物对抗,作为一线治疗方案的话,我们必须找到一种容易实施,容易制造,且与化疗药物价格一样患者能够接受的方式。
解决这一问题的一种比较流行的方式是使用通用型CAR-T,也就是使用来源于他人而非患者自身的T细胞来制造CAR-T细胞。
这方面的研究也很多,比如UCL的免疫学家Waseem Qasim尝试使用捐献者的T细胞并对其进行基因改造,使用TALEN敲掉T细胞表面的TCR以及CD52以避免免疫排斥反应。
但是通用型CAR-T同样面临着与普通CAR-T相同的毒副作用风险,比如在去年八月,一位78岁的患者在接受Cellectis的通用型CAR-T产品UCART123后死于细胞因子释放风暴。
尽管有可能产生脑水肿以及CRS等严重副作用,但CAR-T疗法对于那些患有B-ALL,多发性骨髓瘤等疾病的无药可医患者来说,确实算得上是一种革命性的变革。
但CAR-T领域近期的投资热度之所以如此之高,其实还是因为很多人将CAR-T疗法的未来寄托于实体瘤领域之上。
然而CAR-T疗法在实体瘤领域的应用却存在着无数的障碍。
进军实体瘤
相比在B细胞相关的血液癌症领域的成功,CAR-T疗法在实体瘤领域想要获得突破性进展却难得多。
其实CAR-T疗法在实体瘤领域已经有了非常多的尝试,但到目前为止依然没有取得实质性的进展。
前文中提到了CAR-T疗法对于抗原的三个要求:1 在细胞表面表达。2 该靶点不能在除肿瘤外的,重要的器官或者细胞类型(比如造血干细胞)上出现,即使低水平的表达也有可能引起严重的副作用。3 为了避免抗原逃逸,所有的肿瘤细胞必须都能够表达该抗原,即使该抗原不在所有肿瘤细胞表面表达,也必须对维持tumorigenic phenotype具有至关重要的作用。
我们确实可以找到一些B细胞相关的,非常优秀的CAR-T疗法的靶标,CD19以及BCMA就是很好的例子。但在实体瘤领域,想要找到这样理想的靶点却极其困难。
这是一个非常难以权衡的问题,如果抗原表达过于广泛,毒性反应就有可能会很难控制,如果抗原表达较少,则会影响CAR-T疗法的有效性。
拿HER2这一靶点举例,HER2能够在多种类型肿瘤细胞表面过表达,无论是小分子药物,单克隆抗体药物,还是ADC都已经验证了这一靶点的成药性和副作用的可控性。
但靶向HER2的CAR-T疗法却在治疗第一例病人时就引发了致命的毒性反应,导致病人死亡。
该CAR-T疗法基于第三代的CAR设计(CD28/4-1BB/CD3ζ),并且使用了基于赫赛汀的高亲和性scFv。后来经过分析发现这种毒性反应是由于CAR-T细胞识别肺上皮细胞表面低表达的HER2引起的,CAR-T细胞能够极其猛烈地攻击这些细胞,从而引发了严重的肺功能衰竭。
尽管临床应用的第一例病人就出现了死亡,但后来还是有一些靶向HER2的CAR-T疗法出现。之后的CAR-T疗法产品使用了更低的剂量,并且降低了scFv的亲和力,使安全性有所提升,但遗憾的是即使这些药物能够一定程度上保证该疗法的安全性,在临床试验中也没有发现该类CAR-T疗法能够表现出足够的有效性。
但很多科研人员并没有因此而灰心,目前还有极其众多的实体瘤相关临床研究正在进行,而其中的一些研究或许能让我们看到一丝希望。
一位50岁的男子患有胶质母细胞瘤,并已经向脊柱转移。当时他已经对其他任何类型的治疗都不响应。但在多次接受直接注入中枢神经系统的CAR-T细胞治疗之后病情出现缓解。
这种CAR-T疗法能够靶向表达IL-13受体蛋白的肿瘤细胞,而大部分这类肿瘤能够过表达该类蛋白。
但这确实只是个例,这种个例有多大的说服力我相信每个人的观点都会不一样。除了IL-13R以及HER2,处于临床研究的实体瘤靶点还有很多,比如PSMA,mesothelin,FAP,EGFRvIII, EGFR,CEA,GD2等等。
TCR-T
我相信很多人会跟我一样,对于CAR-T疗法在实体瘤领域应用的态度会很悲观。但很多人同时也会觉得TCR-T疗法会是解决实体瘤障碍的一种比较有潜力的方式,因为TCR-T相比CAR-T在实体瘤领域的靶点选择上会存在一些优势。
CAR-T的scFv跟抗体的作用模式一致,只能够识别在细胞表面表达的抗原,而细胞表面蛋白通常只占细胞蛋白的10%。
但TCR可以识别由MHC递呈的细胞表面以及胞内抗原,因此对于TCR-T疗法来说,其相比CAR-T疗法靶点可选择范围要大得多。
但也不是说TCR-T就没有缺陷,一个比较重要的限制因素是在接受治疗之前需要对患者进行HLA配型。当然目前也有一些新的技术在克服这种障碍。
目前处于临床阶段的TCR-T靶点同样非常多,比如NY-ESO-1,MAGE-A4/A4/A6/A10,WT1,mesothelin,HPV-16E7,AFP等等。
尽管TCR-T疗法能够拓展抗原的选择范围,但无论是过表达的肿瘤抗原或者肿瘤特异性抗原都很难满足之前提到的那三条关于靶点的要求。新的技术依然难以克服靶点选择的障碍,因此也同样很难在保证安全性的情况下达到足够的有效性。
从抗原选择角度来讲,或许新抗原会是比较有潜力的发展方向。新抗原是指由于肿瘤突变而产生的新肽类抗原,因此天生具有肿瘤特异性。然而由于每个病人携带的新抗原都不同,所以基于新抗原的疗法都高度个体化。
我还是比较相信新抗原的潜力的,NCI的Steven Rosenberg多年来一直在进行该领域的研究,有机会的话会在新的文章中重点介绍新抗原领域的进展。
但即使新抗原能够以快速的,并且成本可控的情况下制备新抗原,对于大部分转移性肿瘤患者来说,新抗原也不会起到多大的作用,因为抗原的选择只是CAR-T等细胞疗法面临的障碍之一,即使找到了一个相对优秀的靶标,CAR-T细胞也不太可能达到血液瘤的那种让人觉得震撼的疗效。
实体瘤的重重障碍
要成功清除肿瘤,这些CAR-T细胞必须完成4件事:到达肿瘤附近,进入肿瘤,对抗肿瘤免疫抑制微环境以及杀灭肿瘤细胞。
其中第一项和最后一项是最容易完成的。而正是第二项和第三项阻碍了实体瘤领域的进展。
宾夕法尼亚大学的科研人员曾进行过一项胶质母细胞瘤的临床研究,他们发现靶向EGF receptor III 蛋白的CAR-T疗法,在局部注射药物之后的确能够到达并进入脑内肿瘤,杀灭肿瘤细胞。但是在注射两周之后,T细胞数量就开始下降。
人们总是有这样一种印象,觉得这些经过改造的T细胞能够自发的在体内扩增,自发的攻击肿瘤细胞。但事实却并非如此,这些细胞在回输至人体后会面临着与人体内正常免疫细胞同样的困境,依然需要克服肿瘤微环境的重重免疫抑制。
为了解决实体瘤存在的免疫抑制这一难题,很多人在尝试联用CAR-T疗法以及其他免疫疗法,比如联用检查点抑制剂,从而突破免疫抑制。而且除了直接联用检查点抑制剂,还可以通过基因工程技术敲除T细胞表面的检查点蛋白,理论上来讲这样就有可能达到与联用检查点抑制剂比较类似的效果。
除了以上这些方式,armored CAR-T也是研究比较多的领域,比如通过改造CAR-T细胞使其能够分泌IL-12,IL-15,CD40L 以及 4-1BBL。
前两天Rentier Brentjens实验室还发表了一项研究,使经过改造的CAR-T细胞分泌PD-L1 scFv。
无论armored CAR-T能够多大程度上强化CAR-T疗法治疗实体瘤的潜力,这些研究都与其他肿瘤免疫疗法的研究有着很多的重合。如何克服肿瘤微环境障碍,如何使免疫细胞浸润肿瘤,这些都是包括PD1/L1抑制剂在内的所有肿瘤免疫疗法目前所面临的主要问题。
CAR-T 2.0
其实如果你对CAR-T技术比较感兴趣并且经常关注这个领域的进展的话,你会发现CAR-T领域的新技术五花八门,而这些五花八门的技术很多都是一级市场的宠儿,融资的利器。
由于篇幅所限这篇文章不会囊括所有类型的CAR-T新技术。由于与传统的CAR-T技术存在很大的差别,我们就把这些新技术统称为CAR-T 2.0吧。
文章的上半部分提到了已经有很多研究人员在研究如何使用自杀开关来调控CAR-T细胞活性以确保安全性。但在2015年的时候,UCSF的科学家Wendell Lim 在Science上发表了一项研究,他们设计了另外一种功能独特的开关。
这项新技术叫做Throttle。在这项技术中,小分子能够使CAR蛋白二聚化,以此来活化T细胞。也就是在文章发表的那年,Lim成立了一家新公司叫做Cell Design Labs。
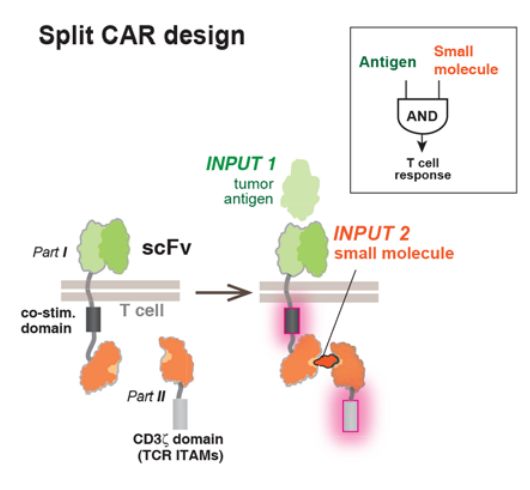
除了Throttle,Cell Design Labs还有另外一项黑科技。
为了提高CAR-T细胞对于抗原的识别能力,Lim实验室设计了一种极为灵活的系统叫做synNotch。一个典型的synNotch包含胞外区域以及跨膜区域,以及胞内转录区。当Notch受体被激活后,胞内转录区能够被剪切释放并且转运至细胞核内,调节靶基因的表达。
通过synNotch与CAR设计的结合,可以使用synNotch来调节CAR的表达,以达到CAR有条件性表达的目的。
我们可以拿卵巢癌治疗来举例,mesothelin是实体瘤CAR-T治疗的一个常见靶标,能够在多种类型的肿瘤中过表达,但也同样能够在正常器官表达,比如肺。
我们在前文中已经提到,普通的CAR-T疗法在应对这种靶标时很难做到安全性与有效性兼顾。
为了解决这一问题,我们可以寻找一种只有在卵巢中表达的蛋白,使其能够结合synNotch,并使其活化,并将synNotch的活化与靶向mesothelin的CAR表达绑定:当synNotch被激活后能够诱导T细胞内的相关CAR表达,这样就能够使CAR-T细胞只能够在卵巢内表达CAR,避免了对其他组织的伤害。不过这只是理论上如此罢了。
Cell Design Labs成立两年之后,在尚无任何产品进入临床研究的情况下,吉利德就宣布以5.67亿美元的价格收购了这家公司。
除了synNotch系统,还有一个比较好玩的研究方向:通过设计一种通用的,不具有抗原识别作用的,并且能够结合抗体的CAR,使所有的CAR-T细胞都表达这种CAR。然后通过抗体来调节CAR-T细胞的靶向特异性。
这样就可以通过更换抗体的种类来调节CAR-T细胞的靶向性,而且可以通过调节抗体药物的剂量来调节CAR-T细胞的活性强度。
Unum Therapeutics一直在进行该领域的研究,并且已经将相关产品推向了临床试验。Unum的技术平台叫做 Antibody-Coupled T cell Receptor(ACTR)。
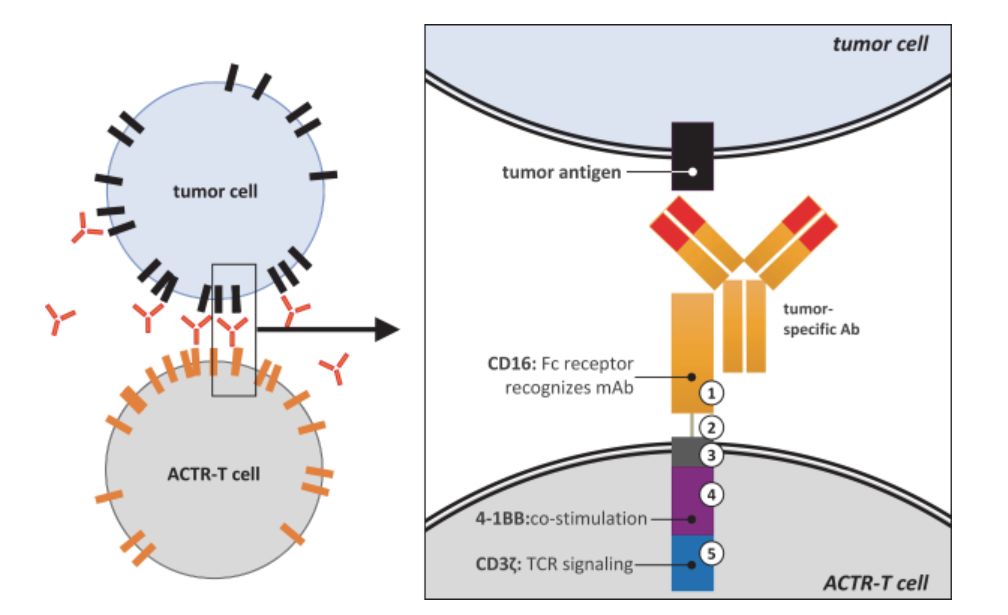
虽然这项技术看起来很有意思,但是在临床试验中却发现这项技术也同样有可能具有极高的风险。
在Unum今年递交的IPO Form S-1中,投资人发现其核心产品ACTR087(基于利妥昔单抗)治疗复发难治性非霍奇金淋巴瘤,临床试验中10例患者3例意外死亡,2例死于细胞因子释放综合征,1例死于神经毒性。相信任何人都不会愿意看到这样的结果。虽然这些新技术看起来很花哨,但同时也具有很大的未知风险。
今年四月的时候,曾经在Lim实验室做博后的Wilson Wong又将这种通用型CAR的理念做到了极致。
Wong在Cell的一篇文章中报道了他们的一项新技术,该技术使用了一种通用型受体叫做SUPRA CAR,这种CAR受体由zipCAR以及zipFv组成,该系统可拆分,可以实现非常精细的调节。论文中的工作完成的非常漂亮,文章的可读性非常高。基于该技术,今年Wong共同创立的一家生物技术公司Senti Biosciences。
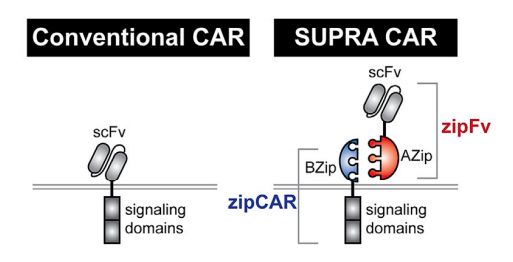
CAR-T领域大概没有比这项技术更复杂的技术了。但技术花哨不一定就说明它有前景,技术越复杂开发成真正能够用于疾病治疗的新疗法的可能性就越低,因为每增加一道操作,就相应地增加了一层风险,从而也就提高了失败的几率。
除了以上这些比较吸引眼球的新技术,CAR-T领域还有很多新思路。比如通过光控,超声来控制CAR-T细胞的活性。
很难预估这些很花哨的新技术究竟能不能落地,何时能落地,究竟多少年之后这些技术才真正地帮助病人,使他们获益。但很明显这些预期短期内是不可能实现的。
或许是受Kymriah以及 Yescarta获批上市的影响,很多投资人总对CAR-T技术有着不切实际的幻想,幻想着这项技术能够为多种肿瘤的治疗带来变革。
但现实总是很残酷,技术的成熟需要极为漫长的时间。CD19以及DCMA等B细胞相关抗原正是所谓的low hanging fruits,是这些靶点的发现成就了CAR-T疗法的成功。但CD19以及DCMA的成功并不意味着我们就能够将胜利扩展到其他肿瘤治疗领域。
究竟CAR-T疗法能不能攻占下一城,获得下一城胜利?
Time will tell.

















