
Yanhong Shi 博士
希望之城的研究者们研发了一种新的干细胞模型,用于评估一种罕见神经系统疾病的治疗方法——亚历山大病。而亚历山大病则是一种与阿尔茨海默病、帕金森病和肌萎缩侧索硬化症(ALS)同疾病群组的神经退行性疾病。这种新型干细胞模型的建立有助于人们更好的了解神经退行性疾病的发展路径,寻找更可行的治疗方案。
Yanhong Shi博士作为本研究中的主要研究者,采取了病理较为简单的亚历山大病作为研究对象,其团队所创建的新型干细胞模型是减缓或治疗阿尔茨海默病和其他神经退行性疾病的方法的关键一步。
大脑神经传输的“高速公路”——髓鞘质
在正常人的大脑中,一种被称作髓鞘质的物质构成了大脑神经网络传输的“高速公路”。在亚历山大病中,星形胶质细胞的突变对一种髓鞘质前体细胞起抑制作用,使得大脑神经传输阻塞。
“ApoE4(载脂蛋白E4)是一种增加阿尔茨海默病风险的基因变种,多存在于星形角质细胞中。”希望之城贝克曼研究所(Beckman Research Institute of City of Hope)干细胞生物学研究部主任Shi博士表示说。因此,我们只要了解到星形角质细胞的工作机制,就可以开发出治疗亚历山大病以及其他涉及到星形角质细胞疾病的治疗方法,比阿尔茨海默病和肌萎缩侧索硬化症(ALS)等。”
这项研究于8月2日发表在《Cell Stem Cell》杂志上,该团队首次攻克了一项重大挑战,即了解星形胶质细胞中GFAP(胶质纤维酸性蛋白)是如何抑制正常髓鞘质分布的问题。在此之前,科学家们尚无法创建出合适的动物模型来观察此类疾病的发展路径。因此,该团队的主要研究者Shi博士和研究生Li Li以及其他同事们创建了一个干细胞模型,以此深入了解亚历山大病。他们还创建了一个用于评估相关神经退行性疾病干预治疗的平台。
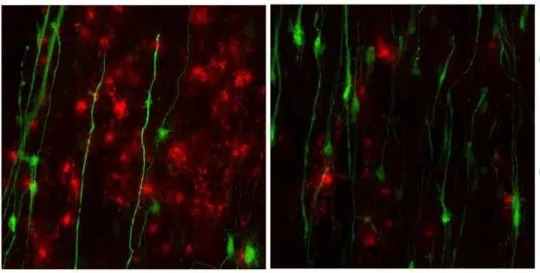
亚历山大病患者干细胞来源的星形胶质细胞(绿色)抑制了髓鞘质的正常分布(Yanhong Shi博士/希望之城)
研究人员创造了源自GFAP基因突变的模型,并与亚历山大病患者的大脑样本进行了比较,发现这两种模型均显示出与这种疾病相关的蛋白质沉积物(罗森塔尔纤维)。
研究人员使用CRIPSR / Cas9基因编程来纠正星形胶质细胞中的GFAP突变,并发现,GFAP突变的纠正减少了与疾病相关的蛋白质沉积。接下来,他们使用这种新型干细胞疾病模型研究了亚历山大病的发展路径。在亚历山大病中,星形胶质细胞抑制了“少突胶质前体细胞”的生长,这是髓鞘质的一种前体细胞,且髓鞘质加速大脑神经的通讯网络。通过比较来源自亚历山大病患者和健康星形胶质细胞中表达的不同基因,研究人员发现GFAP突变星形胶质细胞会分泌出CHI3L1蛋白,这是一种抑制神经发育(包括髓鞘形成)的神经炎症标志物。
Shi博士表示说,针对CHI3L1的治疗,不仅可以治疗亚历山大病,更可以减少其他类型的脑白质病变疾病。尽管多年来,科学家们一直很关注神经元的研究,但更多研究发现,星形胶质细胞在正常脑功能和神经系统疾病中也起着非常重要的作用。”“星形胶质细胞占大脑细胞的很大一部分,和神经炎症密切相关。慢性的神经炎症会导致疾病的产生。问题是如何去预防这种炎症的产生。”Shi博士对此表示。

















