近年来抗癌纳米药物领域的研究进展迅猛,为了达到消灭癌症的终极目标,研究人员可谓绞尽脑汁,各种各样的纳米药物层出不穷,在临床前实验中取得抗癌疗效十分显著,甚至有不少纳米药物现在正在进行临床试验。但是最近一篇Nature Nanotechnology 文章的结论却让人不得不重新考虑这个问题。新加坡国立大学(NUS)David Tai Leong教授及Han Kiat Ho教授等科学家的研究结果表明,常用的无机纳米颗粒,包括二氧化钛、二氧化硅、金纳米颗粒,静脉注射入动物模型后会加速乳腺癌细胞的内渗(intravasation)和外渗(extravasation),增加现有的癌症转移程度并促进新转移位点的出现。而这一切,与血管内皮钙粘蛋白(VE-cadherin)的相互作用有关。
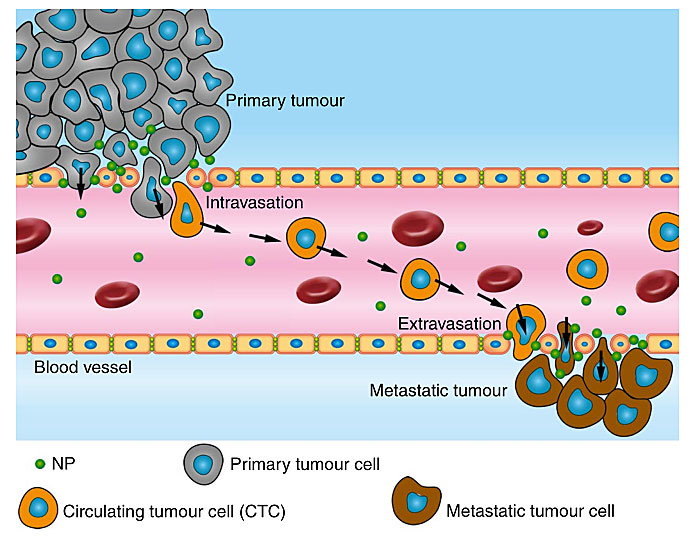
图1. 纳米颗粒(NP)促进癌症转移。图片来源:Nat. Nanotech.
那么这些纳米颗粒到底为什么会成为癌症转移的“帮凶”?它们又是如何“为虎作伥”的呢?
说来话长,故事起源于2013年左右,彼时David Tai Leong教授与南洋理工大学的研究人员合作发现二氧化钛纳米颗粒竟然会通过结合上皮细胞表面的血管内皮钙粘蛋白(VE-cadherin),从而破坏这些蛋白之间的相互作用,扰乱内皮细胞之间的连接,最终导致血管内皮渗漏,即“纳米材料诱导的内皮渗漏(nanomaterials-induced endothelial leakiness, NanoEL)” [1]。David Tai Leong教授本以为这只是一个偶然现象,但是没想到在后续研究中发现金纳米颗粒[2,4]、二氧化硅纳米颗粒 [3] 都具有相似的效应,同时这种扰乱的程度与纳米颗粒的大小[2]、密度 [3] 以及表面电荷[4] 有关系。癌症转移的过程包括癌细胞从原发肿瘤脱落,内渗进入血管,以及在转移部位外渗出血管形成转移灶,内渗和外渗这两个过程都与血管内皮的通透性密切相关。基于以上背景,David Tai Leong教授认为这些纳米颗粒也许可以通过NanoEL促进癌症的转移。认为归认为,事实是否如此还需要数据说话。说干就干,David Tai Leong教授找来了Han Kiat Ho教授合作开启了这个项目。
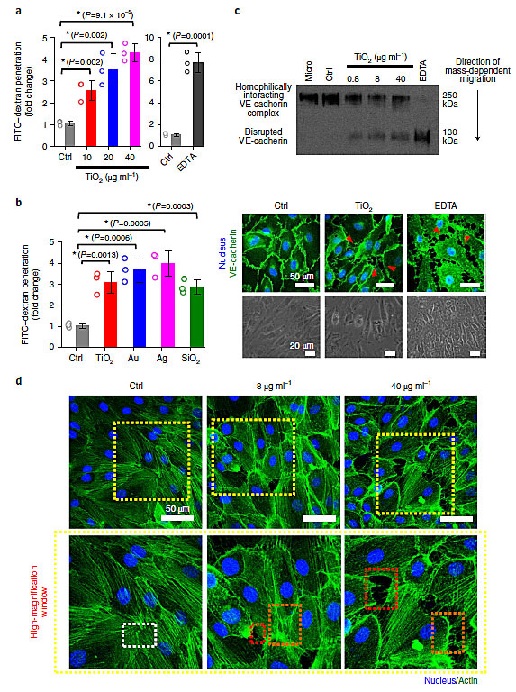
图2. 二氧化钛纳米颗粒通过NanoEL破坏内皮完整性,图片来源:Nat. Nanotech.
首先,作者研究了癌细胞是否会利用NanoEL来穿过内皮细胞层。通过简单的Transwell实验,作者发现二氧化钛和其他纳米颗粒都会导致NanoEL(持续时间至少长达6小时),从而增强内皮细胞层的穿透性,最终促使更多的FITC-dextran穿过细胞层,同时这种效应的强度和纳米颗粒的剂量有关。究其机理,纳米粒子可能通过破坏粘附连接处的血管内皮钙粘蛋白-血管内皮钙粘蛋白的同源相互作用而诱导内皮渗漏。接下来研究人员使用纳米颗粒处理了培养在培养皿中的人乳腺微血管内皮细胞(HMMEC),然后去掉培养基并洗掉纳米颗粒后加入乳腺癌细胞MDA-MB-231(人源乳腺癌细胞系)进行孵育。结果发现,和对照组(磷酸盐缓冲液处理)相比,纳米颗粒处理会使更多的细胞粘附在培养皿上,这意味着癌细胞可以利用纳米颗粒产生的内皮细胞之间的空隙与培养皿接触并粘附其上。有意思的是,如果在加入癌细胞进行孵育的同时加入纳米颗粒,那么粘附在培养皿上的癌细胞数量会有所减少,作者认为这是由于纳米颗粒也破坏了癌细胞与培养皿之间的相互作用,使得粘附的细胞减少。同时作者利用Transwell实验探索了纳米颗粒处理内皮细胞对癌细胞穿过内皮层的能力的影响,结果发现纳米颗粒处理后穿过内皮细胞层的癌细胞数量明显增多,这表明癌细胞会利用NanoEL穿过内皮细胞层,也就意味着癌细胞可以通过NanoEL穿过血管。
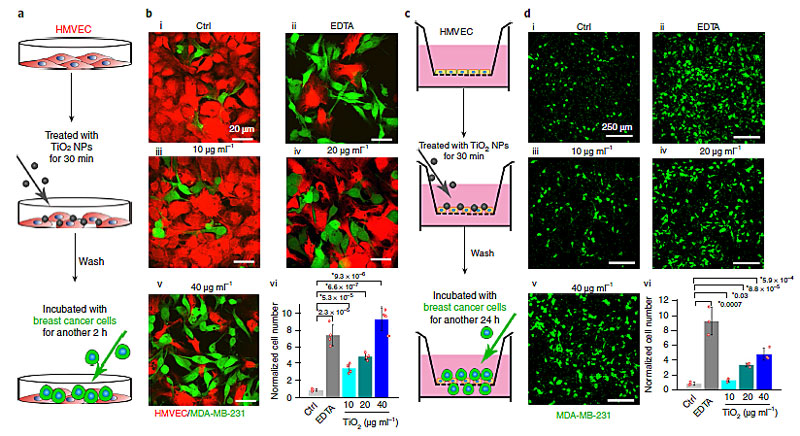
图3. 肿瘤细胞利用NanoEL造成的内皮不完整粘附并穿越内皮细胞层。图片来源:Nat. Nanotech.
接下来作者探索了纳米颗粒是否会促进小鼠体内的癌细胞转移。作者首先检测了纳米颗粒处理(每周3次)荷瘤(MDA-MB-231)小鼠后,小鼠血液中的癌细胞的含量。由于MDA-MB-231是人源细胞,因此作者利用逆转录聚合酶联反应(RT-PCR)检测了血液中的癌细胞的基因表达水平,结果发现在纳米颗粒处理后1-4周内都可以检测到血液中有癌细胞的基因表达,第4周时血液中的循环癌细胞的含量大约是对照组的5倍(10 mg/kg-1)和1.5倍(5 mg/kg-1)。通过活体成像监控,作者发现第4周时纳米颗粒处理组(10 mg/kg-1)有1只小鼠肺部出现了可见的癌转移灶,将小鼠牺牲后进行荧光成像发现纳米颗粒处理组(10 mg/kg-1和5 mg/kg-1)都有小鼠出现了肺部转移灶。这表明纳米颗粒处理小鼠确实会促进原位癌的远端转移,主要是由于NanoEL导致癌细胞更容易从癌组织进入血管。
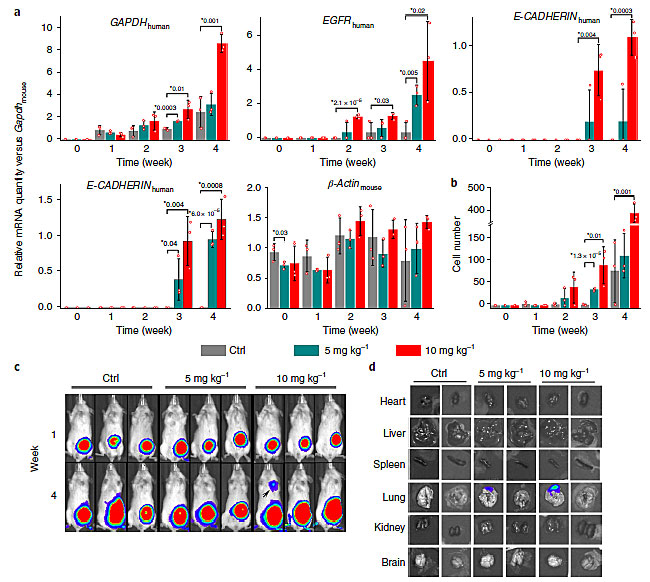
图4. 二氧化钛纳米颗粒通过NanoEL促进原位乳腺癌的转移,图片来源:Nat. Nanotech.
最后作者探索了NanoEL是否会促进循环癌细胞进入其他正常组织。作者先通过尾静脉注射将MDA-MB-231细胞注射到小鼠血液中,随后每周注射3次纳米颗粒,利用小动物成像仪对小鼠体内的癌转移灶的形成进行了监控。结果发现第4周时对照组的小鼠只有肺部可以检测到荧光,而纳米颗粒处理的小鼠在第3周时就可以在肺部和其他脏器中检测到荧光。将小鼠牺牲后取出脏器进行荧光成像,结果发现除了肺部(对照组)之外,纳米颗粒处理后的小鼠的肝(二氧化钛纳米颗粒)、肾(金纳米颗粒和二氧化硅纳米颗粒)都出现了大量的转移灶,组织切片染色也确认了这些结果。这表明血管中的循环癌细胞会利用NanoEL更容易地穿过正常组织的血管壁进入正常组织,从而形成远端转移灶。
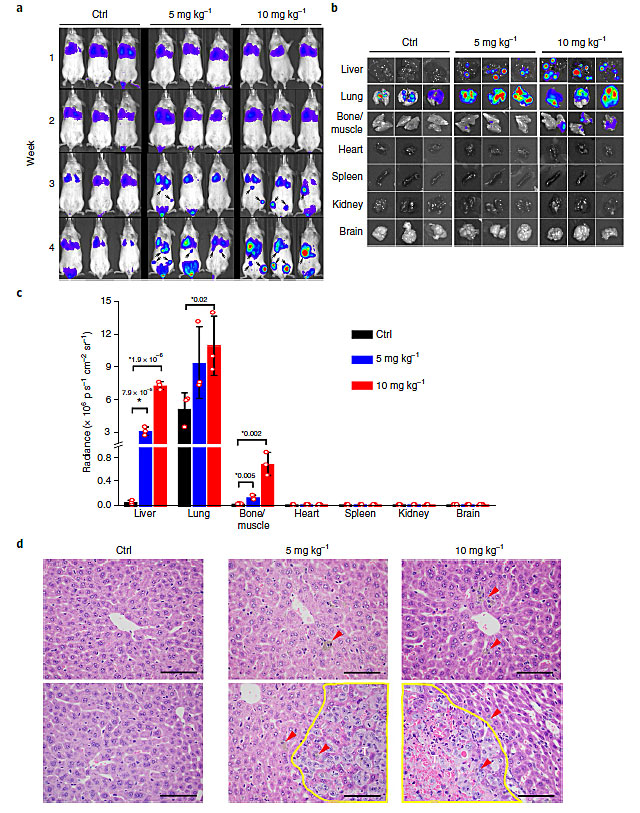
图5. 二氧化钛纳米颗粒通过NanoEL促进循环肿瘤细胞进入正常组织形成转移灶,图片来源:Nat. Nanotech.
综上所述,该研究中作者发现这些常用的无机纳米颗粒可以在体外促进癌细胞粘附在血管内皮细胞层并穿过内皮细胞层,而在体内纳米颗粒可以通过形成NanoEL短时间可逆地破坏血管壁的结构促进乳腺癌细胞的转移。考虑到现在的纳米产品的应用越来越广泛,即使病人不使用抗癌药物,他们也会长期接触纳米颗粒,这可能会导致血管皮结构完整性被破坏,而这就给了癌细胞可乘之机,一方面可以更容易地从原发瘤离开进入血管,另一方面可以更容易从血管进入正常组织,最终导致癌症更容易转移。尽管如此,作者认为NanoEL本身还需要进一步研究,也许通过更先进的设计,克服NanoEL带来的负面影响,甚至利用这个效应增强纳米药物的抗癌疗效。

















