
B-ALL和T-ALL有一定的相似性,但是在开发CAR-T治疗的过程却不尽相同,最重要的因素就是相比B-ALL,靶向T-ALL的难度更大。通常治疗B-ALL是通过CAR-T靶向pan-B细胞抗原,尽管会引起严重、持久的B细胞再生障碍,但整体还是可耐受的,因此这个策略在B-ALL中是可行的。而在T-ALL中,靶向pan-T细胞抗原后的T细胞可能会抑制免疫,更重要的是表达在CAR-T表面的抗原会引起CAR-T细胞的“自相残杀”。
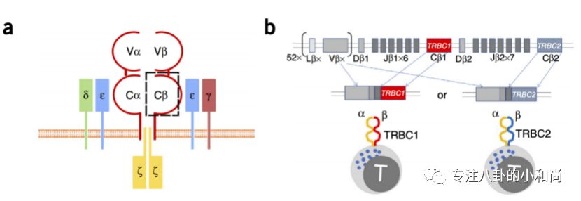
近来有一些研究旨在针对正常T细胞与T细胞肿瘤的差异来设计特异性的CAR-T。Paul Maciocia的研究团队设计了一种基于TCR β亚基的恒定区(TRBC1和TRBC2)的新型CAR-T疗法,旨在针对T细胞恶性肿瘤,人体内的正常T细胞亚群同时含有TRBC1+ T和TRBC2+ T两种类型,而T细胞淋巴瘤细胞由于克隆起源和癌细胞的进化仅含有TRBC1+ T或TRBC2+ T单一类型。但是这种方法只能针对成熟的T细胞恶性淋巴瘤,因为只有一小部分T-ALL细胞表面才表达TCR。
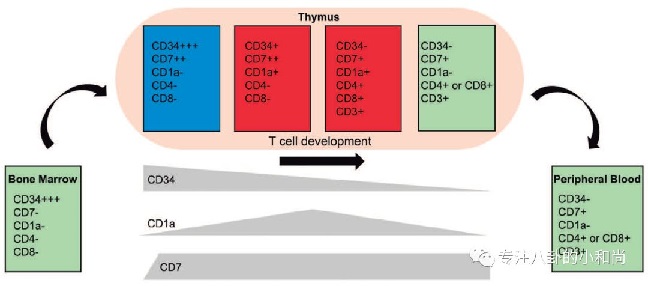
另一个可选的方法制备靶向pan-T细胞抗原的CAR-T时采用这些抗原表达被破坏了的T细胞,常见的例子是CD5或者CD7(见下图),这类方法会引起T细胞功能障碍,通常要进行异体造血干细胞移植来恢复。其实最简便的策略来还是找到那些只在T-ALL表达而不在正常T细胞表达的抗原。
在最近一期的blood上,Sanchez-Martınez的团队指出CD1a就是这样的一类选择性的T-ALL靶点。CD1a是一类跨膜的糖蛋白,向T细胞呈递自身或细菌来源的脂类分子,原本表达在皮肤内树突状细胞(如朗格汉斯细胞)和暂时性表达在发育中的胸腺细胞,严格意义上并不表达在成熟的T细胞上。
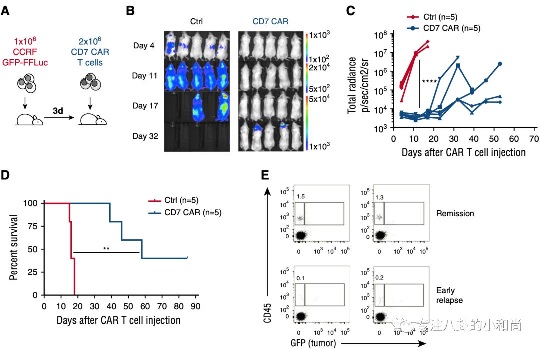
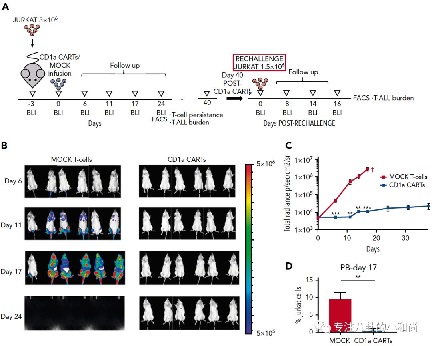
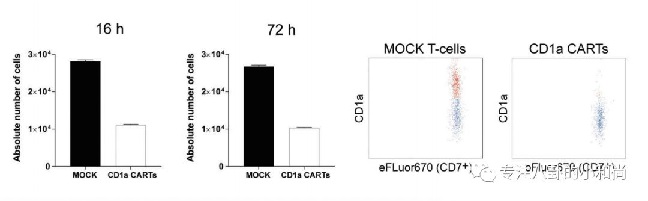
而有研究发现,CD1a在40%的T-ALL中都有表达,这类通常被定义为皮肤性T-ALL。Sanchez-Martınez团队证明CAR-CD1a T的制备不要基因编辑,而且还可以避免“自杀行为”和耗竭,并经体外实验和多个小鼠模型证明可以有效区分正常T细胞并裂解皮肤性T-ALL淋巴母细胞。
更重要的是,当CAR-CD1a T和胎儿胸腺细胞孵育时绝大多数细胞都得以保留,表明这类治疗并不会引起胸腺消融。
但是CD1a做为治疗T-ALL的靶点仍然存在很多不足:
1)只有小部分T-ALL患者才表达CD1a,而CD1a通常和较好的预后相关,因此CD1a+的患者复发或者难治的比例更少;
2)淋巴母细胞的CD1a表达可能并不一致,并且可能会通过表达下调来引起逃逸,因为本身这类靶点对细胞的生存并不关键;
3)还需要进一步详细研究剔除表达CD1a的胸腺细胞和朗格汉斯细胞带来的临床后果,朗格汉斯细胞是皮肤中主要的抗原呈递细胞,也存在与其他粘膜表层,它们的缺失可能引起局部的免疫缺陷或是自免、角化病。
Sanchez-Martınez的工作构也给探索CAR-T治疗T-ALL带来了新的选择。目前除了通过基因编辑来避免“自相残杀”,研究人员还致力于开发可选的靶向策略来避免T细胞再生障碍,比如通过针对一系列“逻辑门”抗原的CAR组合策略来靶向pan-T细胞抗原;而在此基础上多重靶向CD1a这种表达有重叠的抗原可以避免抗原隐形逃逸、扩大潜在的受众患者。所以说本研究对于CAR-T治疗T-ALL来说是十分关键,有助于将CAR-T在B-ALL上的成功推广到T-ALL。

















