CRISPR/Cas9是一项革命性的基因编辑技术,刚刚摘得2020年诺贝尔化学奖。利用这一技术,研究者们能够靶向基因组中的特定序列,剪切和粘贴DNA片段,以可控的方式修改基因组。这一新型基因编辑工具被认为是改变包括癌症在内的遗传性疾病治疗的最有希望的方法之一。
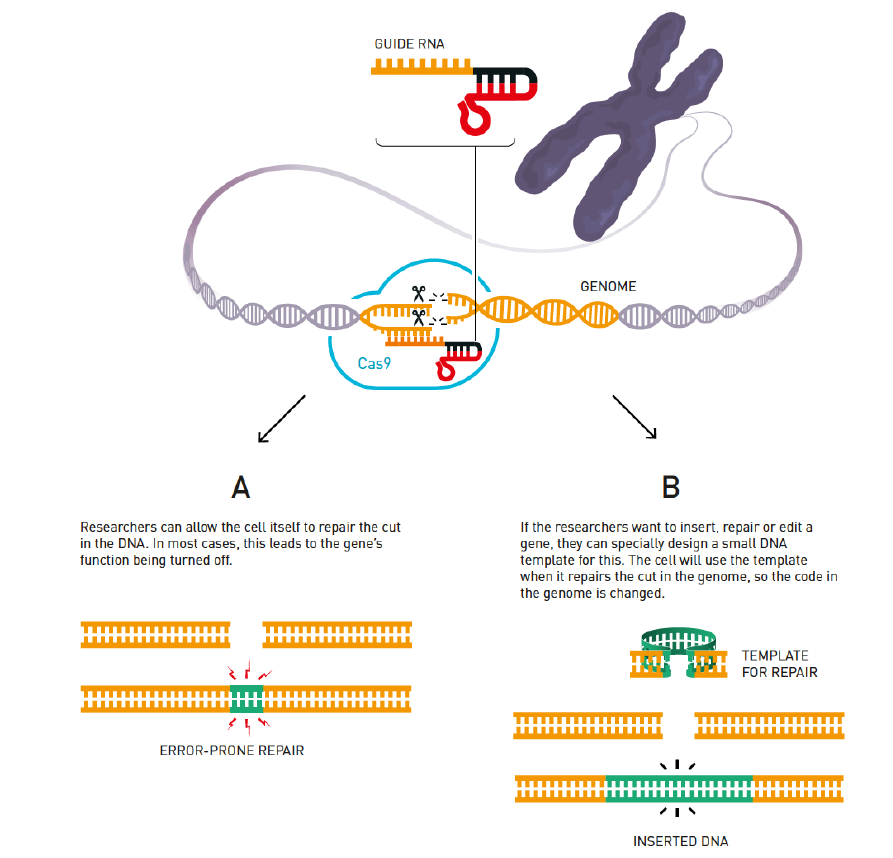
当研究人员利用CRISPR/Cas9编辑基因组时,他们首先会人工构建一个向导RNA,该向导RNA与他们的目标DNA相匹配,之后他们让向导RNA与可将DNA双链切断的Cas9酶形成复合物,向导RNA会将Cas9酶引导到目标位置,之后Cas9酶发挥切割作用。(图片来源:Johan Jarnestad/ The Royal Swedish Academy of Sciences)
10月8日,最新发表在Nature Communications杂志上的一项研究中,由西班牙国家癌症研究中心(CNIO)Sandra Rodríguez-Perales带领的研究团队在利用CRISPR抗癌方面取得了新的突破,首次利用该技术消除了癌细胞中的融合基因。这一创新成果未来有望发展为特异性靶向肿瘤而不影响健康细胞的新型抗癌策略。

融合基因是来自两个不同基因的DNA片段不正确连接的结果,是细胞分裂过程中偶然发生的事件。如果细胞不能从这个“事件”中获益,那么它就会死亡,而融合基因将被清除。但是,如果这个“事件”导致了复制或生存优势,那么携带融合基因的载体细胞就会“繁殖”,而融合基因及其编码的蛋白就会变成触发肿瘤形成的因素。
对癌症基因组图谱数据的分析表明,融合致癌基因(fusion oncogenes)是肿瘤发展的强大驱动因素,驱动了超过16%的人类癌症的发展,包括中胚层癌症(典型的白血病、淋巴瘤和肉瘤)。上皮性癌症中也被发现了融合致癌基因,包括前列腺癌、结直肠癌、乳腺癌和黑色素瘤。
由于融合致癌基因只存在于肿瘤细胞中,因此,引起了科学家们的极大兴趣,因为这表明,它们是高度特异性的治疗靶点,靶向融合致癌基因只会影响肿瘤,而不会损害健康细胞。然而,靶向特定的融合致癌基因仍充满挑战,一方面是因为,特异性识别和靶向嵌合蛋白非常困难,另一方面,由于融合致癌基因产物是位于细胞内的,因此需要有效的途径来递送靶向嵌合转录本或蛋白的治疗分子到细胞内。先前,一些小分子、胞内抗体、适配体已被成功地用于靶向融合蛋白,反义RNA、核酶和RNAi被用于靶向融合转录本。而基因编辑技术的发展为直接靶向和修改癌细胞的基因组序列提供了新的可能性。
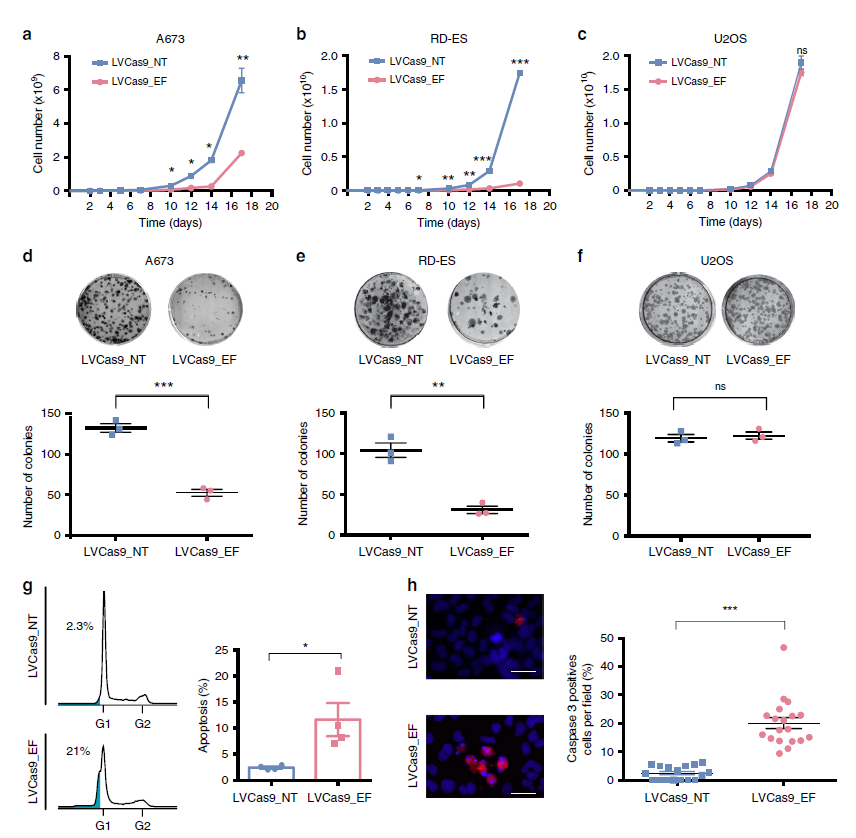 CRISPR介导的EWSR1-FLI1靶向可在体外抑制细胞生长。EWSR1-FLI1是尤文肉瘤中常见的一种融合。(来源:Nature Communications)
CRISPR介导的EWSR1-FLI1靶向可在体外抑制细胞生长。EWSR1-FLI1是尤文肉瘤中常见的一种融合。(来源:Nature Communications)
在这项新研究中,来自CNIO的科学家团队基于CRISPR/Cas9技术设计了一种简单、高效的基因编辑策略,通过靶向参与重排的基因的两个内含子,在癌细胞中高效且特异性地破坏了融合致癌基因。在尤文肉瘤和慢性髓系白血病细胞系和小鼠模型中,利用CRISPR来“切断”导致肿瘤的融合基因成功地清除了肿瘤细胞。
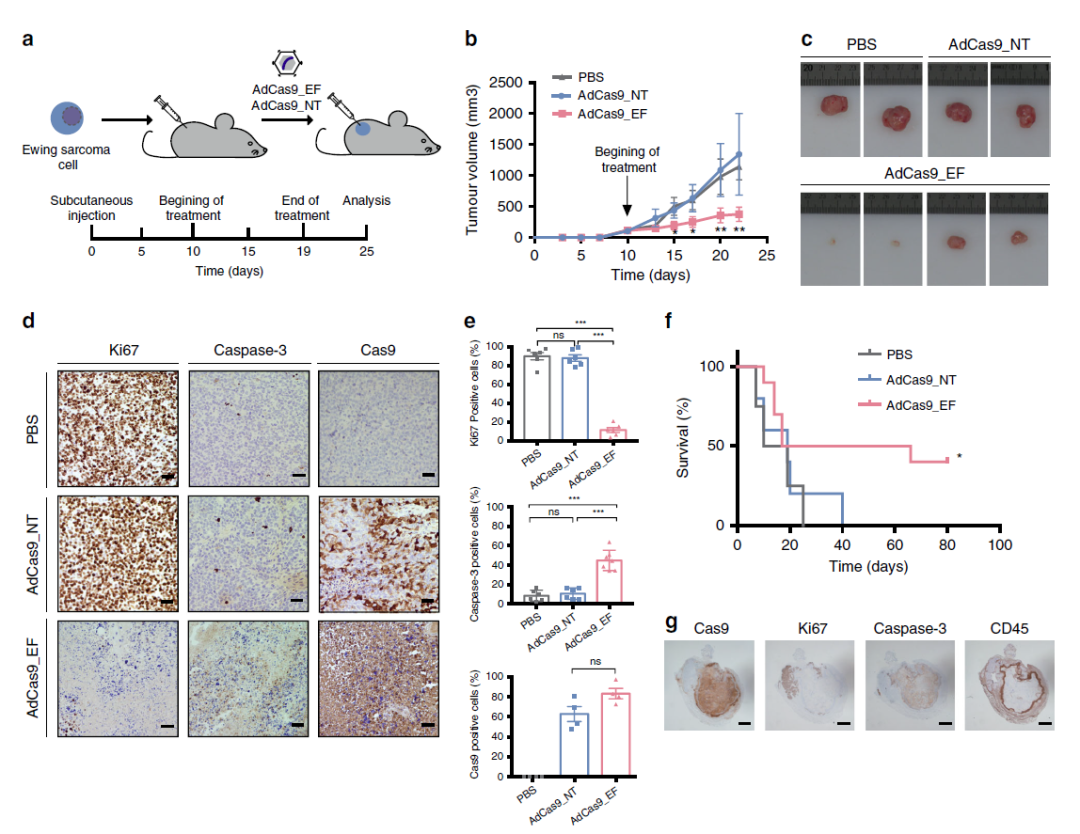 在异种移植模型中,删除EWSR1-FLI1可抑制肿瘤生长(来源:Nature Communications)
在异种移植模型中,删除EWSR1-FLI1可抑制肿瘤生长(来源:Nature Communications)
据称,这是CRISPR首次成功应用于选择性清除肿瘤细胞中的融合基因。其他研究组先前的策略是基于修改参与融合的两个基因之间的连接(junction),引入可诱导癌细胞死亡的一段DNA序列。不过,引入外源序列被证明在清除肿瘤方面效果非常不佳。
CNIO的研究人员使用了一种完全不同的方法来诱导肿瘤细胞自我毁灭。他们的策略是在融合基因两端的内含子(基因的非编码区)上切割两次。通过这种方式,在试图自己修复这些断裂时,细胞会连接被切割的末端,从而导致中间的融合基因被完全清除。而由于该融合基因对细胞的生存至关重要,因此,这种自动修复会导致肿瘤细胞的死亡。
总结来说,该研究提出的基于CRISPR的融合致癌基因靶向策略为选择性清除癌细胞打开了新视野。领导该研究的Rodríguez-Perales表示,下一步,他们将开展更多的研究,分析这种新型抗癌策略的安全性和疗效。此外,研究小组也将调查是否这种策略对由融合基因导致的其它癌症类型也有效。究竟这种方法能否转化为一种临床治疗方案,期待进一步的研究结果。
REF:
1#Team reprograms CRISPR system in mice to eliminate tumor cells without affecting healthy cells(来源:The Spanish National Cancer Research Centre)
2# M. Martinez-Lage et al. In vivo CRISPR/Cas9 targeting of fusion oncogenes for selective elimination of cancer cells. Nature Communications(2020).

















