2021年12月10日,FDA官宣了一条重要的好消息!BOIN设计获得美国FDA的Fit-for-Purpose认证。这是第一个由华人教授发明的获得FDA官方认证的创新I期临床设计,也是继获得中国CDE认可之后(详见《抗肿瘤药物临床试验统计学设计指导原则(试行)》),BOIN设计在全球重要药品监管机构取得的又一重要认证。大量研究表明BOIN设计具有简洁的决策规则、优越的统计性能和扎实的统计基础。FDA也在其审评文件中肯定了BOIN设计的优越性能,并认证其适用于研究目的是确定最大耐受剂量(MTD)的I期临床试验。FDA的认证通知(图片来源:FDA官网)
BOIN设计产生的背景
恶性肿瘤是人类健康的第一大杀手。大多数肿瘤预后较差,患者生存时间短,缺乏可治愈的手段,因此,抗肿瘤药物已成为当下创新药研发的热点。目前,早期肿瘤临床试验大多依靠传统的设计方法。例如在I期剂量探索试验中,“3+3”设计仍然是主要使用的方法。“3+3”设计虽易于应用,但统计性能较差,是导致研发成功率低下的原因之一。因此,开发创新的临床试验设计并将其逐步推向临床应用具有重要的现实意义。
关于BOIN设计
BOIN设计,全称是贝叶斯最优区间设计(Bayesian Optimal Interval design),是由美国德克萨斯大学MD Anderson癌症中心的袁鹰教授团队在2015年提出的一种I期临床试验剂量探索设计方法,具有操作简便,性能优良的特点。在BOIN设计框架下,研究者只需将当前剂量下的观测DLT率与预设的最优化剂量增减边界进行简单的比较便可做出剂量增减决策。
- 第一组受试者以最低剂量进行治疗,在DLT观察期内观察发生DLT的受试者例数。
- 计算DLT发生率p,然后和试验前给定的边界值λe和λd做比较,决定下一组受试者接受治疗的剂量水平。若p ≤ λe,增加一个剂量水平;若p > λd,降低一个剂量水平;若λe < p ≤ λd,维持当前剂量(λe和λd与目标DLT率有关,通过最小化错误决策的后验概率来确定)。
经过统计理论推导,在BOIN设计中使用无信息先验时,最优的剂量增减边界与当前剂量水平上治疗的患者数无关!
这使得BOIN设计尤其简洁。只需计算当前剂量毒性率的点估计,再与边界进行比较即可方便地进行剂量升降决策。例如在目标毒性率为25%时,若当前剂量的DLT率 ≤ 0.197,则升高一个剂量水平;若DLT率 > 0.298,则降低一个剂量水平;否则,维持当前剂量
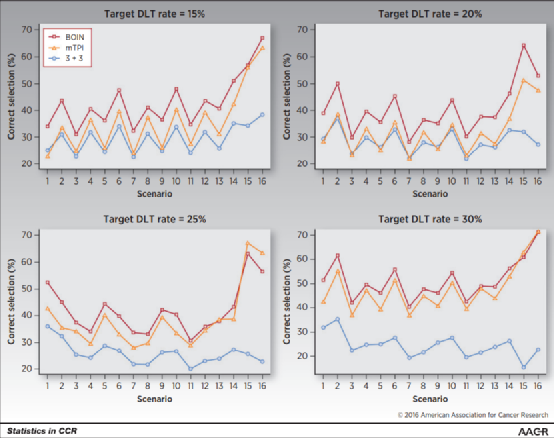
模拟研究表明,BOIN在大多数场景下的表现性能都优于3+3设计和mTPI设计(详见参考资料4)。
BOIN目前已经发展成为一个完整的设计平台以解决不同的临床需求。例如针对毒性延迟效应的TITE-BOIN,考虑药物联合治疗中剂量探索问题的BOIN Comb,同时考虑毒性和有效性以确定最优生物剂量的U-BOIN和BOIN12,可纳入先验信息的iBOIN等。具体的方法选择可见下图所示的BOIN设计家族决策树。
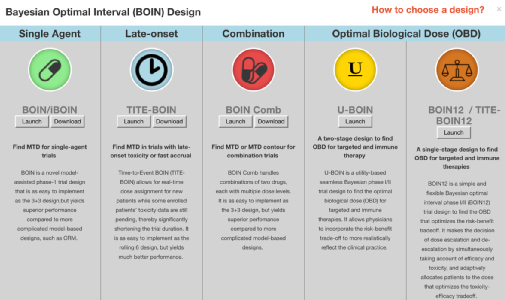
BOIN设计决策树
用户可免费使用http://www.trialdesign.org或http://www.trialdesign.cn(中国国内站点)提供的可视化的应用程序进行临床设计。在网页上使用这些方法时,使用者无需编写程序,只要根据实际情况选择合适的设计,填写相应的参数即可快速生成决策表格,还可以自定义场景进行试验模拟,其界面简洁、操作直观,能够一键生成多种格式报告。
(图片来源:http://www.trialdesign.cn)
04
BOIN设计能够预先指定剂量递增的规则,而且易于实施,具有选择目标毒性概率和队列大小的灵活性,还具有与基于模型的设计相当的性能,因此受到了越来越多研究者的青睐。据悉,目前已有400余项I期临床试验使用BOIN进行剂量爬坡。
我们和致力于新药研发的广大朋友们分享袁鹰教授团队的好消息,并在本文中简单介绍了BOIN设计的基础理论和使用方法,希望能对大家学习、理解和实施I期临床试验设计有所帮助。
值得注意的是,虽然BOIN设计有着上述诸多的优点,但在实际应用前,还是需要生物统计师与临床医生对试验药物的特性、疾病的特点、给药方案、设计的合理性等方面进行充分的评估。
药时代将继续跟踪报道,包括对袁鹰教授进行专访。欢迎朋友们关注!
参考资料
1. 国家药监局药审中心关于发布《抗肿瘤药物临床试验统计学设计指导原则(试行)》的通告(2020年第61号)https://www.cde.org.cn/main/news/viewInfoCommon/b8a33e6df753b13e091b83b8d5a412f8
2. FDA Drug Development Tools:Fit-for-Purpose Initiative. https://www.fda.gov/drugs/development-approval-process-drugs/drug-development-tools-fit-purpose-initiative
3. Liu, S., & Yuan, Y.(2015). Bayesian optimal interval designs for phase I clinical trials. Journal of the Royal Statistical Society:Series C:Applied Statistics, 507-523.
4. Yuan, Y., Hess, K. R., Hilsenbeck, S. G., & Gilbert, M. R.(2016). Bayesian optimal interval design:a simple and well-performing design for phase I oncology trials. Clinical Cancer Research, 22(17), 4291-4301.
5.Yan F, Zhang L, Zhou Y, Pan H, Liu, S, Yuan Y.(2020). BOIN:An R Package for Designing Single-Agent and Drug-Combination Dose-Finding Trials Using
Bayesian Optimal Interval Designs. Journal of Statistical Software. 94(13).
6. Gainor, J. F., Curigliano, G., Kim, D. W., Lee, D. H., Besse, B., Baik, C. S., … & Subbiah, V.(2021). Pralsetinib for RET fusion-positive non-small-cell lung cancer(ARROW):a multi-cohort, open-label, phase 1/2 study. The Lancet Oncology.
7. Subbiah, V., Hu, M. I., Wirth, L. J., Schuler, M., Mansfield, A. S., Curigliano, G & Taylor, M. H.(2021). Pralsetinib for patients with advanced or metastatic RET-altered thyroid cancer(ARROW):a multi-cohort, open-label, registrational, phase 1/2 study. The Lancet Diabetes & Endocrinology.
8. Zhou Y, Lin R, Kuo YW, Lee JJ, Yuan Y.(2021). BOIN Suite:A Software Platform to Design and Implement Novel Early-Phase Clinical Trials. JCO Clin Cancer Inform. 5:91-101

















