今日,顶尖学术期刊《自然》发表了一篇来自著名科学家张锋教授团队的最新论文。这位基因编辑领域的先驱者带领Broad研究所的团队,开发了一种全新的蛋白质递送系统,未来有望在基因疗法、癌症治疗等一系列领域发挥作用。
这项突破性技术的原理并不难理解:利用细菌“注射器”,将蛋白质注射到人类细胞中。
其灵感来自于一些细菌天然具有的注射结构:胞外可收缩注射系统(eCIS)。这是一种类似于注射器的大分子复合物,驱动细菌用一根刺突穿过真核细胞的细胞膜,将蛋白质注射到细胞里。
一些共生细菌演化出这种递送系统侵染寄主细胞。例如昆虫致病菌发光杆菌(Photorhabdus),就会将其可收缩注射系统分泌到胞外,然后把携带的蛋白质注入昆虫细胞并将细胞杀死。
 ▲透射电镜下,经过纯化的发光杆菌“注射器”(图片来源:参考资料[2];Credit:Joseph Kreitz)
▲透射电镜下,经过纯化的发光杆菌“注射器”(图片来源:参考资料[2];Credit:Joseph Kreitz) 这套细菌自带的系统让科学家们长期困扰的一个问题有了新的解决灵感:如何以精准、高效地方法将治疗性的分子递送到特定类型的人类细胞中去。“向大自然学习如何运输蛋白质,让我们开发出了一个新的平台。”张锋教授说。
根据发光杆菌eCIS的结构组成,其一端外侧的尾部纤维能识别细胞表面的特定受体并锚定在宿主细胞上,因此研究人员猜测,修改这些尾部纤维的结构,可以使其学会识别不同的细胞。
于是,研究团队使用人工智能蛋白设计平台AlphaFold,通过氨基酸序列预测蛋白质结构,重新设计了发光杆菌的注射器,使之从靶向结合昆虫细胞改为靶向结合人类细胞。类似的,这套系统也可以学会靶向小鼠细胞。细胞实验的结果显示,经过改造,“注射器”识别人类细胞和小鼠细胞的效果接近100%。
同时,研究人员通过重新设计发光杆菌eCIS的另一部分,还能根据需要让它们装载不同的蛋白质,包括基因编辑系统的核酸酶Cas9、碱基编辑器、可以杀死癌细胞的毒素等。
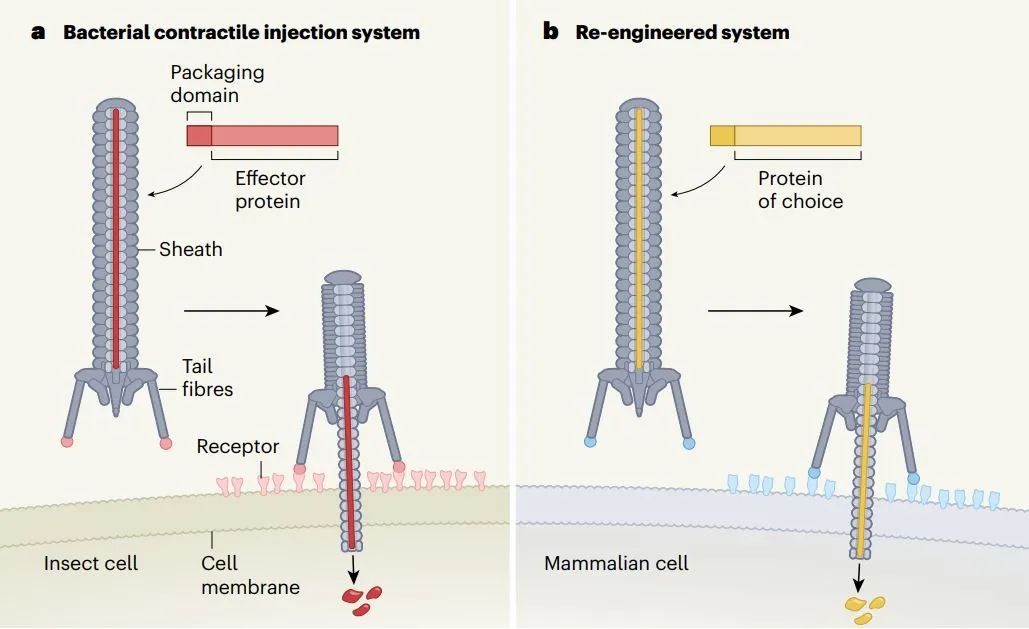 ▲重新设计细菌的胞外可收缩注射系统,将其改造为专门靶向特定人类细胞递送所需蛋白质的装置(图片来源:参考资料[2])
▲重新设计细菌的胞外可收缩注射系统,将其改造为专门靶向特定人类细胞递送所需蛋白质的装置(图片来源:参考资料[2]) 研究团队制作了一种eCIS,专门针对表达EGFR的癌细胞,并向其注射毒素。实验结果表明,它们杀死了几乎100%的EGFR阳性细胞,与此同时不影响没有EGFR的细胞,显示出了强大的靶标特异性。
利用这一系统,研究团队还成功地在小鼠体内将蛋白质送入了活体小鼠的大脑中,并且发现没有诱发局部免疫反应,这也意味着这套递送系统有望在将来安全地用于向人类递送基因疗法。
 ▲张锋教授领导了这项最新研究(图片来源:张锋教授实验室主页)
▲张锋教授领导了这项最新研究(图片来源:张锋教授实验室主页) 这项研究的第一作者Joseph Kreitz博士认为,eCIS系统还有很多待挖掘的潜力,例如未来可以通过重新设计其他组件,以调整其他属性,或递送其他类型的分子,如DNA或RNA。
《自然》同期刊发的专家评述指出,这套递送系统是“一个令人兴奋的生物技术工具箱,其可定制性为多种生物医学应用打开了大门”。
参考资料:
[1] Joseph Kreitz et al.,(2023)Programmable protein delivery with a bacterial contractile injection system. Nature DOI:10.1038/s41586-023-05870-7
[2] Charles F. Ericson & Martin Pilhofer(2023)Mix-and-match tools for protein injection into cells. Nature Doi:https://doi.org/10.1038/d41586-023-00847-y
[3] Bacterial injection system delivers proteins in mice and human cells. Retrieved Mar. 29, 2023 from https://www.eurekalert.org/news-releases/983929

















