导读
近日,2021年诺贝尔化学奖得主、普林斯顿大学默克催化中心David W. C. MacMillan教授课题组在Science上报道了一种镍自由基分选介导的醇-醇交叉偶联,其中两个醇片段在同一个反应器中脱氧并偶联,对空气开放。Ruizhe Chen、Nicholas E. Intermaggio、谢嘉欣博士、James A. Rossi-Ashton为论文共同第一作者,文章链接DOI:10.1126/science.adl5890
正文
有机化学的一个关键目标是发现能够从丰富且稳定的起始原料形成新C-C键的合成方法。醇是一种富含C(sp3)的天然官能团,在天然和商业来源中普遍存在。两个醇片段之间的单官能团交叉偶联将能够获得前所未有的化学空间(图1A)。
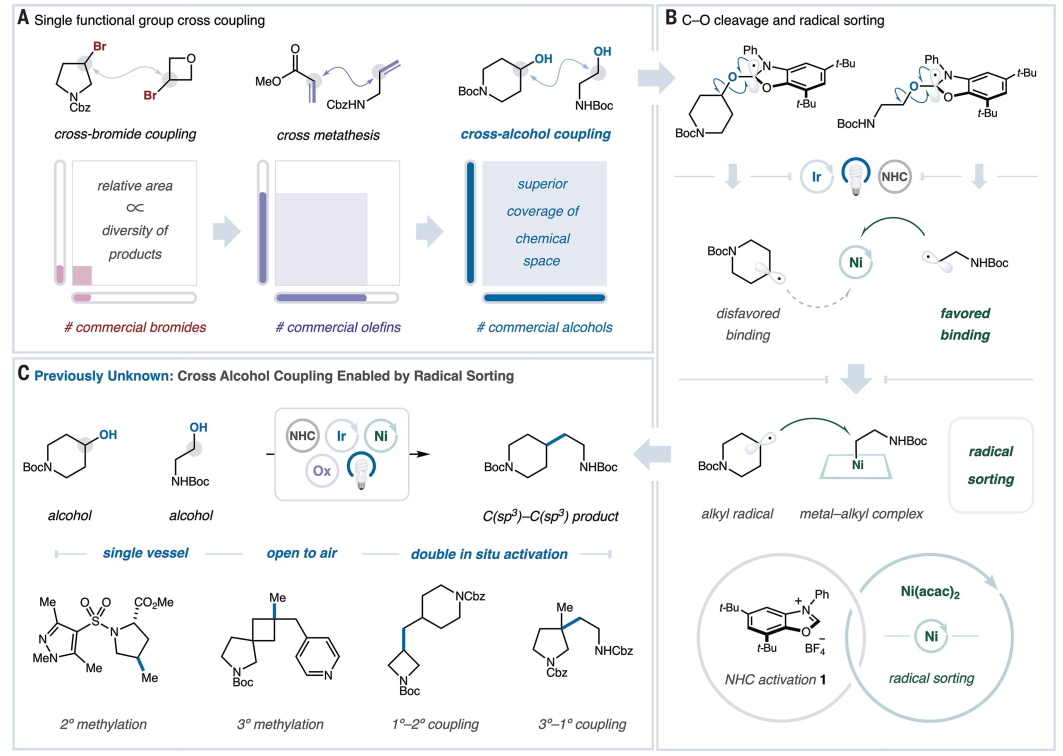
图1. 反应设计(图片来源:Science)
作者最近报道了使用N-杂环卡宾(NHC)盐对醇进行光氧化还原原位脱氧(Nature, 2021, 598, 451-456)。该平台已用于激活一种醇结构单元,将其转化为瞬态烷基自由基,然后能够与各种配偶体形成新键。预计这些NHC试剂可用于同时激活同一烧瓶内的两个醇砌块,为高度模块化的交叉醇偶联提供基础。此外,无论醇取代模式如何,NHC-醇加合物都会快速淬灭光催化剂的激发态,这防止了一种偶联配偶体相对于另一种偶联配偶体的优先消耗。尽管如此,反应途径将通过两种不同自由基的中介进行,这种情况通常会导致重组和歧化产物的复杂混合物。下载化学加APP到你手机,收获更多商业合作机会。
为了应对这一挑战,作者试图利用过渡金属在空间基础上稳定和区分烷基自由基的能力。金属-烷基键的强度随着烷基取代度的增加而降低。这种特性导致“自由基分选”效应,其中两个自由基中取代程度较低的被选择性捕获,从而形成更稳定的金属-烷基络合物。此外,合适的金属催化剂不仅具有分选自由基的潜力,而且还可以通过双分子均裂取代(SH2)介导C(sp3)-C(sp3)键的形成。自由基分选和SH2的结合可以成功介导两个瞬时烷基自由基之间的交叉选择性C(sp3)-C(sp3)偶联(图1B)。
反应机制如图2所示。两种醇将与苯并噁唑鎓1(NHC-1)预混合,同时在单个反应容器中形成两种 NHC-醇加合物。随后任一加合物与合适光催化剂的激发态结合将导致通过氧化-去质子化和β-断裂形成相应的烷基自由基。温和的氧化剂可以快速转变还原的光催化剂,使其恢复到Ir(III)基态并引发第二次光氧化,产生替代的烷基自由基。一旦形成,烷基自由基将通过合适的金属催化剂进行分类,并随后进行C(sp3)-C(sp3)交叉偶联。
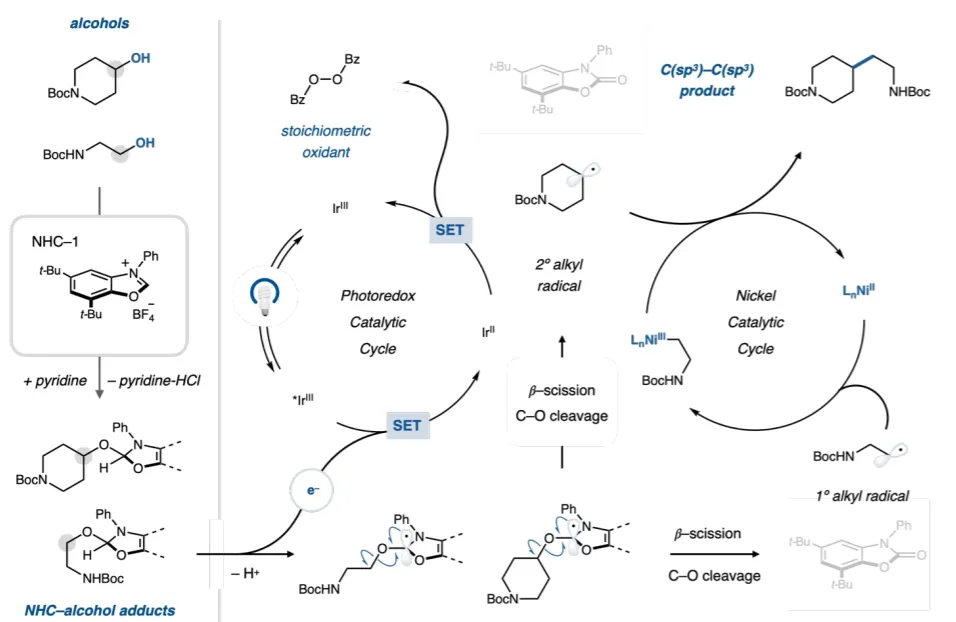
图2. 可能的反应机制(图片来源:Science)
首先,作者将优化的重点放在仲(2°)醇与甲醇的交叉偶联上。只需在弱碱性条件下将两种醇底物与NHC盐1混合,然后直接添加原位生成的SH2催化剂 Tp*Ni(acac)、Ir[dF(CF3)ppy]2(dtbbpy)PF6、奎宁丁、过氧化苯甲酰和二甲基亚砜(DMSO)在蓝色发光二极管(LED)照射1小时后产生高产率的甲基化产物。自由基分选机制是有效的,与随机自由基-自由基重组相比,使得两个瞬时烷基自由基能够以更高的效率结合。在本文的转化中,不需要吡啶鎓盐过滤,这可简化反应装置,其中醇在单个反应烧瓶中被活化、脱氧和交叉偶联。至关重要的是,无需采取任何预防措施来排除空气或水分即可保持反应效率,这一功能突出了该方案的稳健性和用户友好性。本文的交叉醇偶联通常仅需要1.0至1.5当量的甲醇即可实现高产率。
有了最佳反应条件,作者探索这种与甲醇的交叉醇偶联的范围(图 3)。尽管自由基取代模式差异很小,但伯醇可以与甲醇有效交叉偶联,产生甲基化产物 2(产率 51%)和 3(产率 55%)。对于仲醇,多种环系,包括七元、六元、五元和四元饱和杂环,都可以以良好至优异的产率(4-11、55至70%产率)进行甲基化。一系列螺环体系也以良好的产率进行了有效的交叉偶联(12-15、51%至63%的产率)。此外,通过简单地将甲醇与CD3OD 交换,将无环仲醇L-苏氨酸甲酯直接转化为非常规的L-缬氨酸-d3,产率 66%,无需使用冗长的从头合成。此外,高苯甲醇和苯胺环系统附加的醇可以直接甲基化,产率分别为 56% 和 68%(18 和 19)。
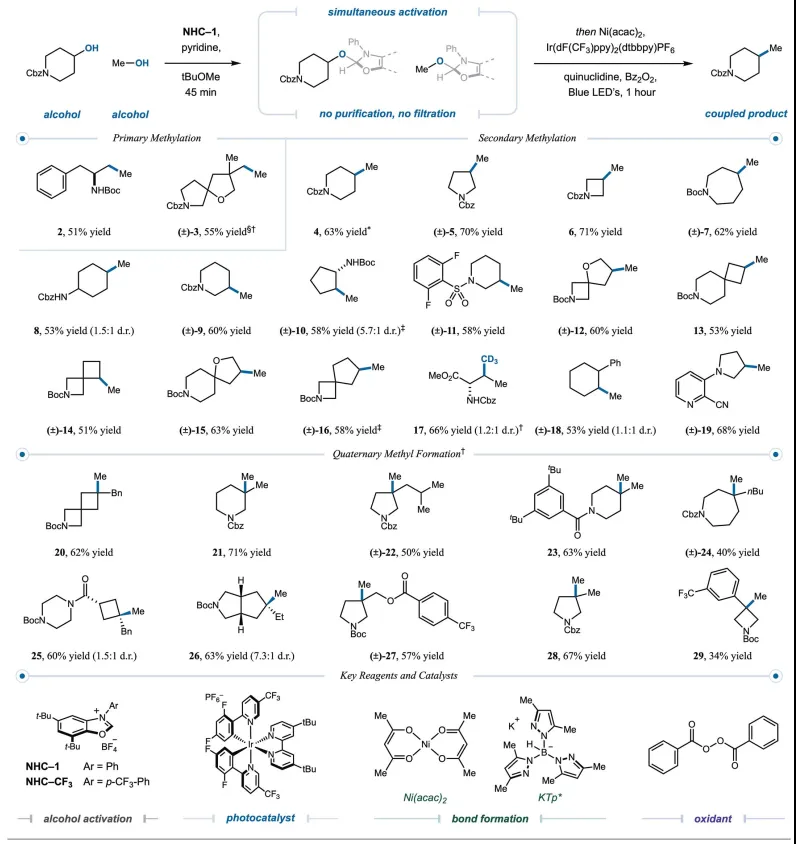
图3. 和甲醇交叉醇偶联的底物范围(图片来源:Science)
作者使用亲电性更强的三氟甲基化NHC活化剂(NHC-CF3)和2当量的甲醇,对一系列叔醇进行了一组改良后的反应条件。发现可以构建一系列结构多样的季碳。
存在于四元、五元、六元和七元饱和杂环上的环状叔醇全部转化为合成上有用的季甲基化产物,收率优异(21-25和28、40%至71%收率)。此外,带有叔醇的螺环和双环体系也可以交叉偶联,分别以62%的产率(20)和63%的产率(26)产生甲基化产物。与叔醇相邻的氧杂原子具有良好的耐受性,从而产生良好的季碳形成产率(27,产率57%)。最后,可以通过与甲醇的交叉醇偶联来构建芳基化季碳,其合成产率(29、34%)。
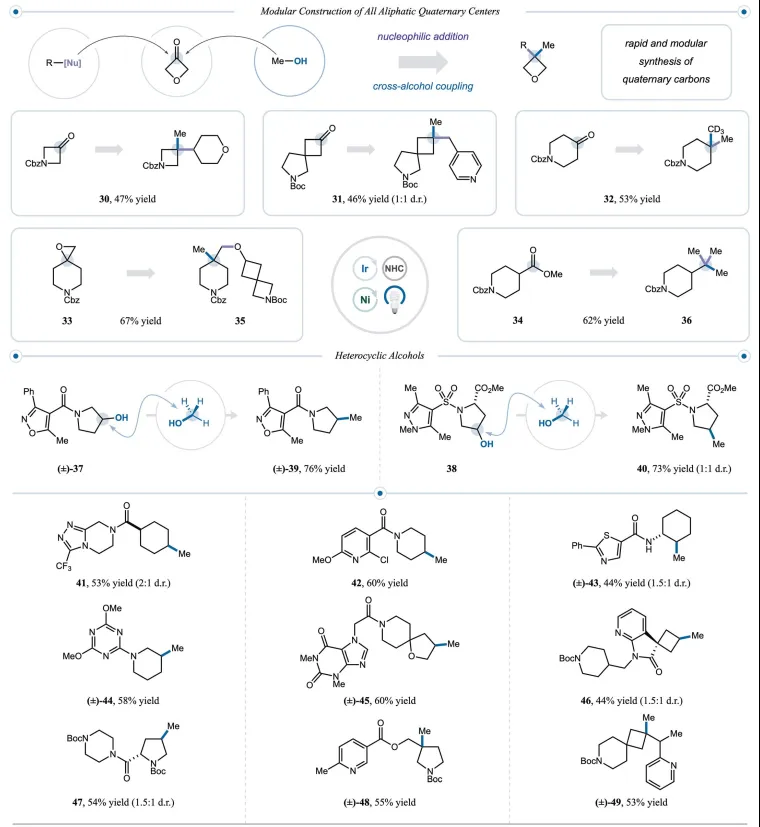
图4. 全碳季碳中心和杂环醇的模块化构建(图片来源:Science)
鉴于叔醇可以通过简单的亲核加成与天然亲电官能团广泛获得,作者意识到有机会通过两个合成步骤将酮、酯和环氧化物转化为季碳(图4)。为此,将一系列酮与结构不同的有机金属亲核试剂反应,将它们转化为相应的3°醇,这些醇可以参与与甲醇或CD3OD的交叉醇偶联,以良好的产率提供季碳30、31和32 (收率分别为 47%、47%和53%)。此外,对环氧化物33和甲酯34进行亲核加成,然后将所得叔醇甲基化,以良好的产率提供了季碳产物35和36(产率分别为67%和62%)。
接下来作者将注意力转向带有药用相关杂环的醇的甲基化。为此,将异噁唑37和吡唑磺酰胺38置于本文的反应条件下,以优异的产率生成了所需的甲基化产物。此外,三唑并哌嗪41、噻唑43、三嗪44和哌嗪47都可以转化为合成上有用的相应甲基化产物,收率良好(44%至58%收率)。
杂环化合物,如吡啶 42、嘌呤 45 和氮杂吲哚 46,可能对净氧化、开壳交叉偶联构成挑战,因为它们在 Minisci 型反应中倾向于接受自由基。然而,在本文的最佳条件下,带有所有此类杂环的醇以良好的产率(43%至60%的产率)进行甲基化。此外,从吡啶48和49形成季碳中心,产率分别为 55%和53%。
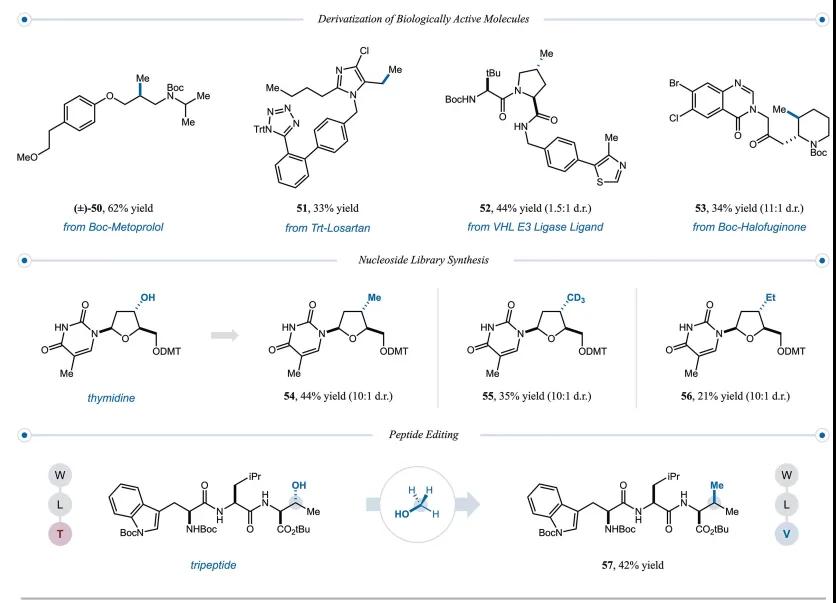
图5. 复杂分子应用(图片来源:Science)
作者还探索了生物活性分子的后期功能化(图5)。美托洛尔(50)、氯沙坦(51)、VHL E3连接酶结合剂(52)和卤常酮(53)的甲基化类似物都可以在合成后期合成,具有良好的产率(33%至62%产率),避免了通过多步合成这些类似物所需的时间和资源。
将胸苷与甲醇、CD3OD和乙醇进行交叉醇偶联。所需的甲基、CD3和乙基类似物的产率分别为44%(54)、35%(55)和 21%(56)。
最后,作者在后期肽修饰的背景下探索了交叉醇偶联。将色氨酸-亮氨酸-苏氨酸三肽置于交叉醇甲基化条件下。苏氨酸侧链中的仲羟基与甲基的交换将构成氨基酸向缬氨酸残基的互变。缬氨酸产物57的产率为42%,代表通过一个简单的合成操作成功地将三肽从W-L-T 编辑为W-L-V。在彻底探索了各种醇和甲醇之间的交叉醇偶联后,作者接下来探索了通过任意两种不同取代的醇之间的交叉偶联形成一般的C(sp3)-C(sp3)键。
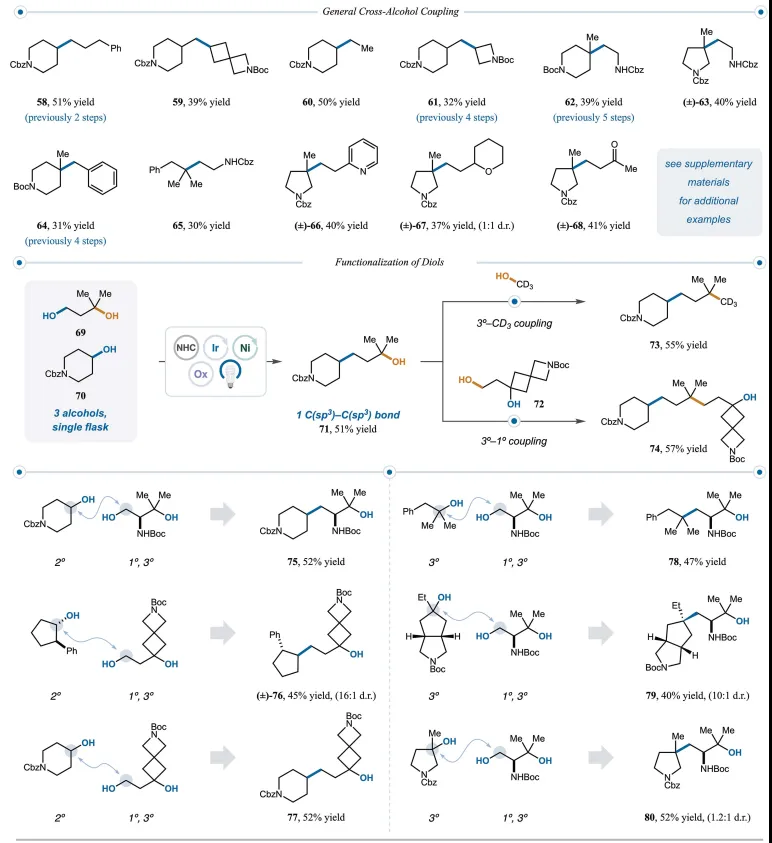
图6. 一般交叉醇偶联(图片来源:Science)
在最佳反应条件下,可以轻松实现高度模块化的C(sp3)-C(sp3)片段偶联(图6)。因此,不同环尺寸的 2° 和 1° 醇在合成上具有良好的效率(58-61、32%至51% 产率)。值得注意的是,3°和1°醇之间的交叉醇偶联导致以模块化且用户友好的方式构建季碳。环状和无环叔醇在一次合成操作中偶联,以合成有用的收率(62- 68、30%至41%收率)提供全脂肪族季碳产物。
接下来,作者研究了二醇的迭代功能化作为快速获得复杂的、富含C(sp3)结构的方法。醇和NHC盐之间的缩合速率由空间位阻决定(MeOH > 1° > 2° >> 3°)。基于这一趋势,预计差异取代的二醇将代表交叉偶联的正交功能手柄。将1°、3° 二醇(69)在与2°醇70相同的烧瓶中进行缩合。发现通过 1° 和 2° 醇的选择性脱氧,以51%的产率形成了71。在此阶段,71中剩余的3°醇可以与CD3OD或72进行另一轮交叉醇偶联,分别以55%和57%的产率提供复杂的季碳产物73和74。事实证明,这种迭代功能化的第一步非常稳健,可实现高原料吞吐量并单次产生超过 700 毫克的中间体醇 71。1°、3°二醇的官能团化非常成功,提供了一系列复杂的2°-1°偶联产物(75-77、45%至52%产率)以及3°-1°偶联产物(78-80、40%至52%产率)。
总结
David W. C. MacMillan团队报道了一种交叉偶联技术,该技术通过单一、稳健且用户友好的步骤从最丰富和多样化的烷基片段构建五种不同类别的C(sp3)-C(sp3)键。本文的交叉醇偶联技术将对应用化学科学产生直接影响,大大丰富了碳碳键的构建方法。
文献详情:
Ruizhe Chen, Nicholas E. Intermaggio, Jiaxin Xie, James A. Rossi-Ashton, Colin A. Gould, Robert T. Martin, Jesús Alcázar, David W. C. MacMillan*. Alcohol-alcohol cross-coupling enabled by SH2 radical sorting. Science, 2024, https://www.science.org/doi/10.1126/science.adl5890

















