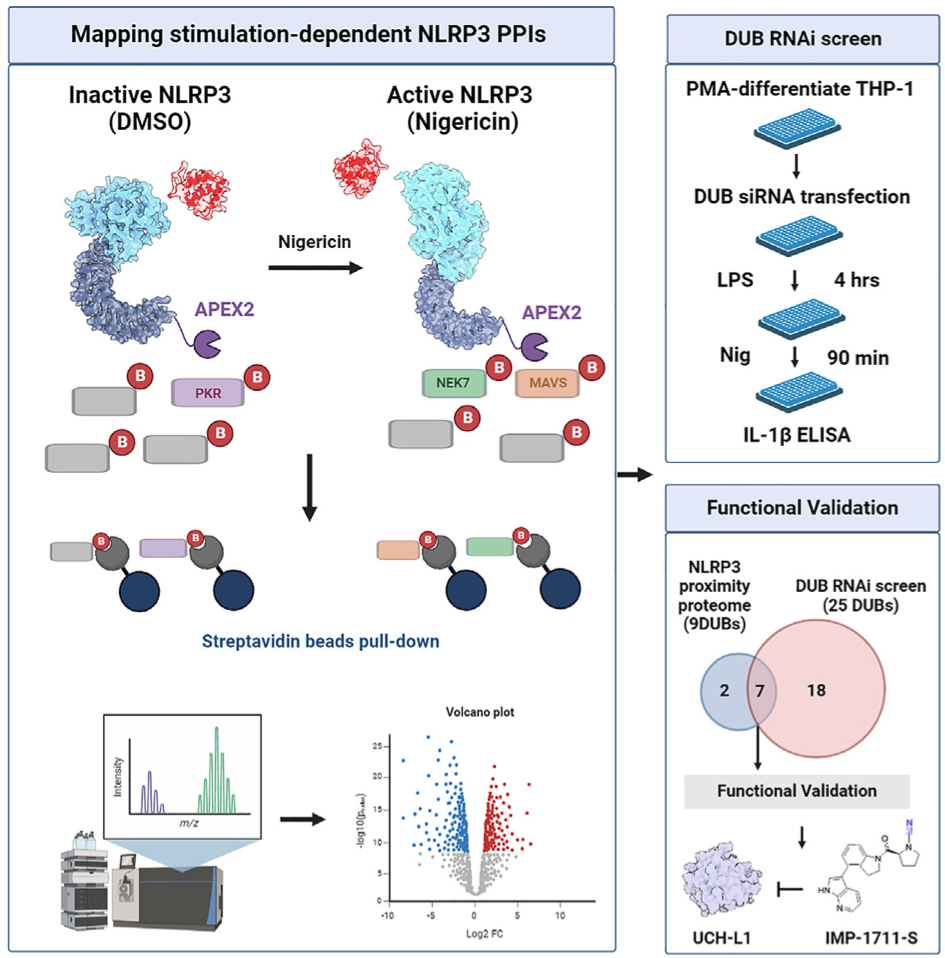
Activation of the NACHT, LRR, and PYD domains-containing protein 3(NLRP3)inflammasome complex is an essential innate immune signaling mechanism. To reveal how human NLRP3 inflammasome assembly and activation are controlled, in particular by components of the ubiquitin system, proximity labeling, affinity purification, and RNAi screening approaches were performed. Our study provides an intricate time-resolved molecular map of different phases of NLRP3 inflammasome activation. Also, we show that ubiquitin C-terminal hydrolase 1(UCH-L1)interacts with the NACHT domain of NLRP3. Downregulation of UCH-L1 decreases pro-interleukin-1β(IL-1β)levels. UCH-L1 chemical inhibition with small molecules interfered with NLRP3 puncta formation and ASC oligomerization, leading to altered IL-1β cleavage and secretion, particularly in microglia cells, which exhibited elevated UCH-L1 expression as compared to monocytes/macrophages. Altogether, we profiled NLRP3 inflammasome activation dynamics and highlight UCH-L1 as an important modulator of NLRP3-mediated IL-1β production, suggesting that a pharmacological inhibitor of UCH-L1 may decrease inflammation-associated pathologies.
激活含NACHT、LRR和PYD结构域的蛋白3(NLRP3)炎性小体复合物是一种重要的先天性免疫信号机制。为了揭示人类 NLRP3 炎症小体的组装和激活是如何受控的,特别是如何受泛素系统成分的控制,我们采用了接近标记、亲和纯化和 RNAi 筛选等方法。我们的研究为 NLRP3 炎症小体活化的不同阶段提供了复杂的时间分辨分子图谱。此外,我们还发现泛素 C 端水解酶 1(UCH-L1)与 NLRP3 的 NACHT 结构域相互作用。下调 UCH-L1 会降低前白细胞介素-1β(IL-1β)的水平。用小分子对 UCH-L1 进行化学抑制会干扰 NLRP3 的点状形成和 ASC 的寡聚,从而导致 IL-1β 的裂解和分泌发生改变,尤其是在小胶质细胞中,与单核细胞/巨噬细胞相比,小胶质细胞的 UCH-L1 表达更高。总之,我们分析了NLRP3炎性体的活化动态,并强调UCH-L1是NLRP3介导的IL-1β产生的一个重要调节因子,这表明UCH-L1的药理抑制剂可能会减少炎症相关的病变。
实验结果1
NLRP3-APEX2 捕获 NLRP3 分子邻近网络
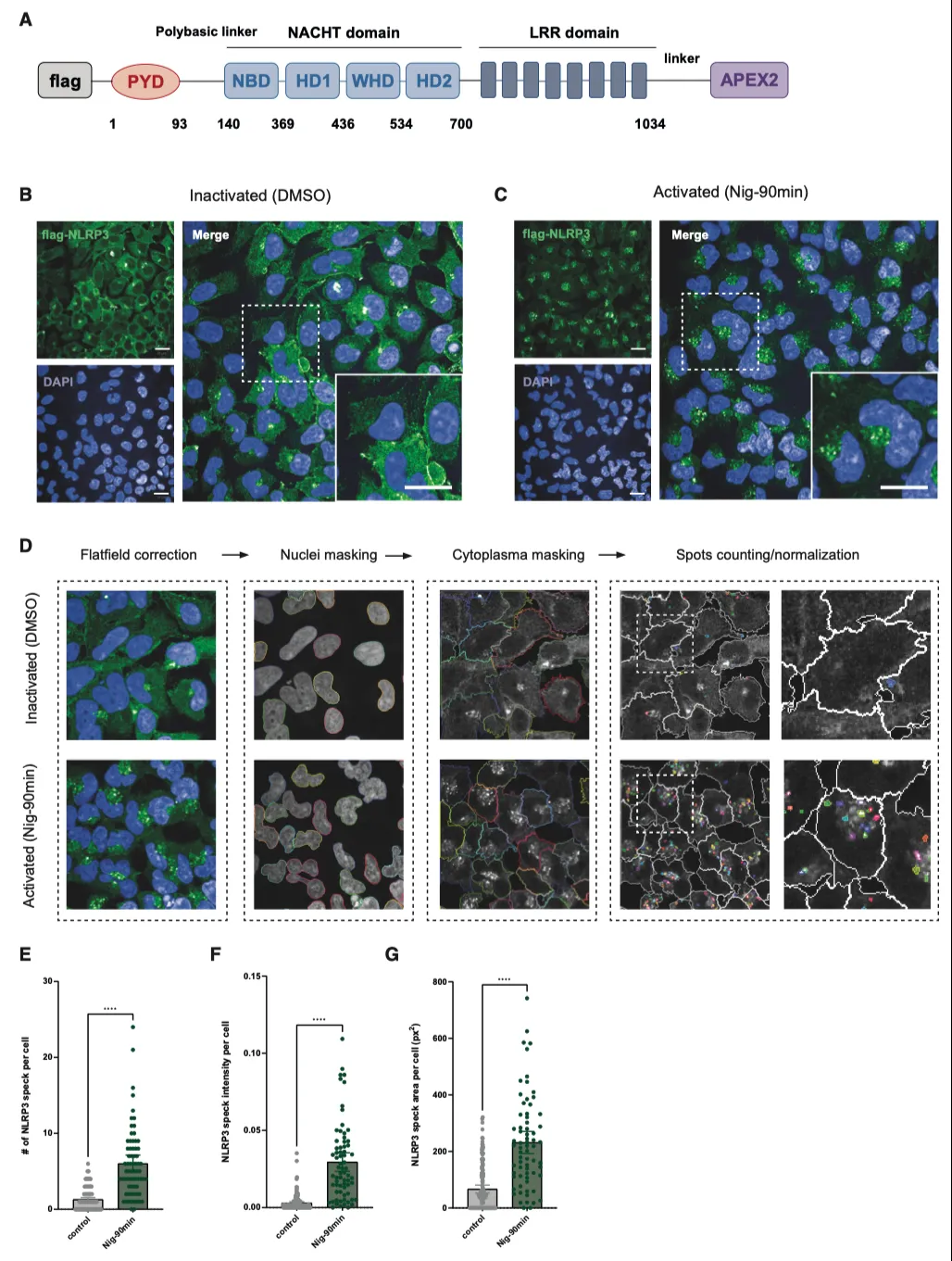
据报道,N末端的NLRP3PYD结构域负责启动NLRP3寡聚化,因此作者在NLRP3的C末端(LRR结构域)插入了APEX2,包括这些结构域之间的柔性连接体和N末端的FLAG表位(图1A)。为了避免在瞬时转染过程中出现表达不稳定和定位错误的情况,作者利用 Flp-In T-REx 系统生成了 NLRP3-APEX2 HEK293 稳定细胞系,从而可以用四环素进行剂量依赖性表达控制。荧光显微镜证实,FLAG-NLRP3 和 FLAG-NLRP3-APEX2 都能在尼日利亚菌素刺激下在核周区域形成点状,而融合蛋白在静息状态下则弥散于整个细胞质(图 1B、1C)。定量分析显示,NLRP3 和 NLRP3-APEX2 斑点形成之间没有形态学改变(图 1D-1G)。此外,在稳定细胞系中共同表达适配蛋白 ASC 的 ASC 寡聚试验证明,FLAG-NLRP3 和 FLAG-NLRP3-APEX2 都能招募 ASC 并在尼日利亚菌素刺激下诱导其聚合。综上所述,这些结果表明,融合到 NLRP3 C 末端的 APEX2 标签并不妨碍其感知刺激(尤其是尼日利亚菌素诱导的钾外流)并招募 ASC 形成寡聚体的能力。
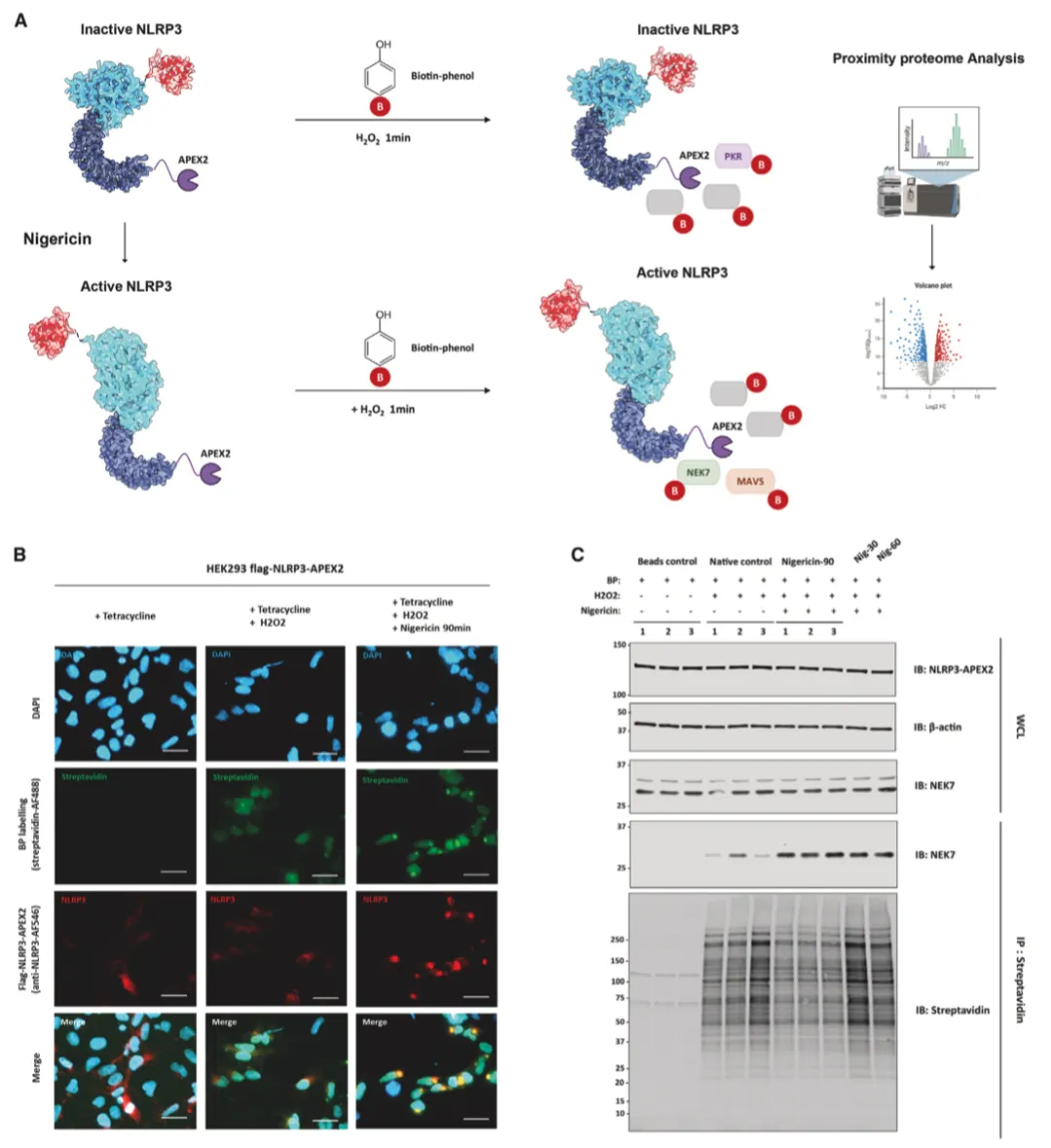
作者接下来研究了生物素标记是否在空间上受限于融合饵料。用或不用尼日利亚菌素处理表达 NLRP3-APEX2 的 HEK293 活细胞。随后,在生物素-苯酚存在下用 H2O2 处理细胞,然后进行快速淬灭、甲醇固定和染色(图 2A)。与没有经过 H2O2 处理的原生对照组相比,作者通过链霉亲和素-Alexa Fluor 488 成像观察到了强大的生物素化作用。在未受刺激的条件下,NLRP3-APEX2弥散于整个细胞膜,生物素化的蛋白质也遵循类似的分布模式。经尼日利亚菌素处理后,NLRP3-APEX2寡聚形成点状,靠近细胞核,作者还观察到生物素标记蛋白形成的斑点(图 2B)。这部分表明了 NLRP3-APEX2 诱导的生物素化的空间特异性。
使用链霉亲和素免疫印迹和库马西蓝染色评估了 APEX2 有效标记和捕获 NLPR3 "近体 "的能力,证实了 APEX2 与 NLRP3 融合后具有强大的生物素标记活性(图 2C)。首先,作者研究了 APEX2 是否能够捕获已知的 NLRP3 相互作用蛋白 NIMA 相关激酶 7(NEK7)。与未标记的阴性对照不同,作者发现 NLRP3-APEX2 能特异性地生物素化 NEK7。此外,与活化的 NLRP3 相关的 NEK7 蛋白封存量也大幅增加(图 2C)。
鉴于 APEX2 近距离标记的快速动力学特性,作者接下来试图绘制 NLRP3 受尼日利亚菌素刺激后在不同时间间隔内的时空分辨 "近距离 "图。经过质谱分析,在 DMSO 对照组和尼日利亚菌素处理 30 分钟、60 分钟和 90 分钟期间共检测到 3478 个蛋白质。为了最大限度地提高信噪比,并从背景污染物中区分出真正的相互作用伙伴,应用了基于贝叶斯模型的相互作用组显著性分析算法(SAINTexpress),得到了 800-1100 个 NLRP3 近端蛋白(图 3A、3B)。无监督主成分分析(PCA)显示了不同蛋白质亚群的聚类和模式(图 3C)。每组中三个生物重复序列之间的相关性很高,证实了该实验的技术变异很小。
为了评估 NLRP3 接近蛋白质组的特异性,作者接下来试图检查已知的 NLRP3 相互作用因子或调节因子是否被生物素化并被 APEX2 捕获。通过比较诱饵和阴性珠对照的猎物蛋白丰度,计算出 SAINT 概率评分和更简单的折叠变化(FC)。从公共相互作用资源库 BioGRID(https://thebiogrid.org/, v.4.4.209)和文献25,26,27 中检索到的 83 个先前报道的人类 NLRP3 相互作用因子被绘制成图,并采用严格的阈值[SAINT 概率 > 0.8,主要折叠变化分数(FC-A)≥ 1]。经过筛选,在近端蛋白质组学数据中发现了 18 个已知的 NLRP3 相互作用蛋白(35%)作为高置信度命中蛋白(图 3D-3H ),证实了 NLRP3 相关蛋白的富集。
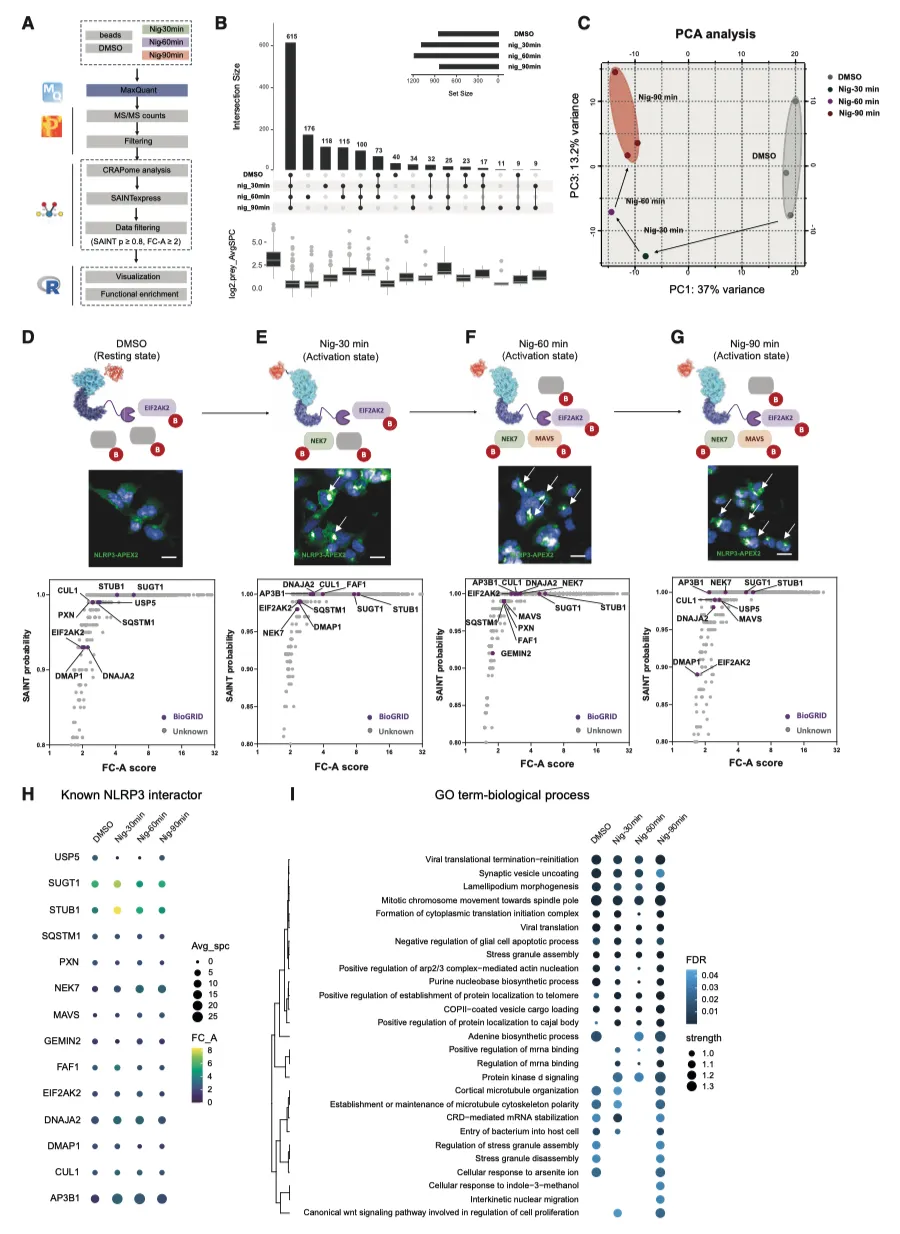
实验结果2
NLRP3 接近性蛋白质组的时间追踪
为了从机理和功能上深入了解尼日利亚菌素不同时间间隔刺激后的 NLRP3 近似蛋白质组,作者进行了基因本体术语-生物过程(GOBP)富集分析(图 3I)。病毒翻译、细胞凋亡调控、应激颗粒组装和有丝分裂相关过程等 13 个共有术语在所有四组中都得到了显著富集。与未受刺激的对照组相比,与 "蛋白激酶 D 信号转导 "和 "mRNA 结合调控 "相关的通路在尼日利亚菌素暴露后唯一出现,这与之前的观察结果一致 。之前的报道证实了这种联系,应激颗粒蛋白 DDX3X 是一个关键的介质,它在凋亡 ASC斑点形成和促生存应激信号之间起调节作用。从 GO 术语-分子功能(GOMF)富集分析来看,"GTP 依赖性蛋白结合 "和 "1-磷脂酰骨化醇结合 "仅在尼日利亚菌素-60 分钟组和尼日利亚菌素-90 分钟组显著富集,表明尼日利亚菌素处理可能诱导了与上述两种生物学功能相关的蛋白的招募。GO术语-细胞组分(GOCC)分析确定了16个常见的亚细胞区室或复合物,包括衣壳蛋白复合物II(COPII)囊泡衣壳、运输所需的内体分选复合物-0(ESCRT-0)复合物和伴侣蛋白复合物。值得注意的是,三种内吞再循环相关复合物,包括内吞相关再循环蛋白(EARP)复合物、内吞至质粒转运囊泡和高尔基相关逆行蛋白(GARP)复合物,仅在尼日利亚菌素-60 分钟组和尼日利亚菌素-90 分钟组显著富集,这表明 NLRP3 复合物可能在刺激后转运至跨高尔基网络(TGN)或内体。同样,区室富集分析发现了另外四个复合物(Dcp1-Dcp2、信号识别受体、MAD1 和凝聚素 I 复合物),它们只在尼日利亚菌素处理的最后两个时间点被捕获并富集。作者还进行了组织富集分析,毫不奇怪,在未受刺激组或受刺激组都观察到组织特异性很差。为了进一步探索生理和病理生物过程,作者对临近蛋白质组进行了 Reactome 通路分析。值得注意的是,一些与先天免疫和病毒感染相关的通路,如 IL-6 信号传导、主要组织相容性复合体(MHC)Ⅰ类和 PP2A 介导的关键代谢因子去磷酸化等,都被识别并富集。
实验结果3
定位分析显示,NLRP3 在受到刺激时会发生易位
由于 NLRP3 的亚细胞重定位及其潜在机制仍存在争议 ,作者进行了定位分析,以评估 NLRP3 炎性体在复合体组装过程中的空间特性。经过过滤、归一化和估算后,作者比较了未刺激状态(DMSO)和刺激状态(尼日利亚菌素-90 分钟)下生物素化蛋白的相对丰度。由此得出的火山图显示,受刺激状态下有 103 个蛋白质富集在右象限,静息状态下有 104 个蛋白质富集在左象限,FC 和错误发现率的截止值相对严格(log2[FC] ≥ 0.5 或 ≤ -0.5,错误发现率 [FDR] ≤ 0.05)。对任一条件下差异富集的蛋白质进行了 GO 项-CC 富集分析。刺激条件下的临近蛋白质组显示出高尔基体的高度空间特异性,有 24 个蛋白质属于 GO-CC 术语类别 "高尔基体膜"。这与之前的观察结果一致,即 NLRP3 在各种刺激下被激活并被招募到分散的 TGN(dTGN)。
实验结果4
利用 APEX2-PL 和 AP-MS 绘制依赖刺激的 NLRP3 相互作用改变图
作者采用一种结合了 APEX2 近端标记(PL)和亲和纯化-质谱分析(AP-MS)的综合方法,进一步研究了激活过程中 NLRP3 局部环境的变化(图 4A)。就 APEX2 PL-MS 而言,SAINTexpress 分析鉴定了 848 个(DMSO)和 833 个(Nig-90 min)近端蛋白,而 AP-MS 方法则捕获了 188 个(DMSO)和 148 个(Nig-90 min)潜在的相互作用蛋白(图 4A、4B)。PL-MS 和 AP-MS 重叠的蛋白质数量相对较少,这可能是这两种技术互补的结果(图 4C 和 4D),也与之前 BioID 和 AP-MS 的比较结果一致。
此外,作者还试图比较静息和激活状态下的 NLRP3 近端蛋白质组。在尼日利亚菌素处理后,依赖于刺激的 NLRP3 相互作用子预计会发生不同程度的生物素化。为了对近端蛋白质组进行去噪,作者使用接收者操作特征(ROC)分析来确定截止值。根据 ROC 分析,作者设定了 TPR(真阳性率)-FPR(假阳性率)达到最大值的临界点,结果发现在激活状态下有 72 个 NLRP3 相关蛋白,在静息状态下有 55 个。值得注意的是,有 7 个已知的 NLRP3 相互作用蛋白得到了不同程度的富集。其中,右象限富集的五个蛋白(NEK7、MAVS、PRKD1、PRKD2 和 PRKD3,红色突出显示)是 NLRP3 已确定的正调控因子,而左象限的 EIF2AK2 和 LYN(绿色突出显示)是先前表征的抑制介质。有趣的是,作者注意到在活化条件下 NLRP3 的标记和捕获增加了,这可能是由于寡聚化所致(图 4E)。
为了直观地了解刺激依赖性相互作用网络并推断相关的生物学见解,作者进行了 PPI 网络分析(图 4F)。至于尼日利亚菌素刺激状态,作者确定了包括 NLRP3 炎症小体(NEK7 和 MAVS)、可溶性 N-乙基马来酰亚胺敏感因子附着蛋白受体(SNARE)复合物、COPII 囊泡外套、跨高尔基网络(TGN)和蛋白激酶 D 信号传导复合物在内的蛋白质复合物。在非刺激状态下,细胞粘附分子、翻译起始因子、Ephrin 信号传导以及 Janus 激酶(JAK)-信号转导和转录激活因子(STAT)通路等复合物明显富集(图 4F)。
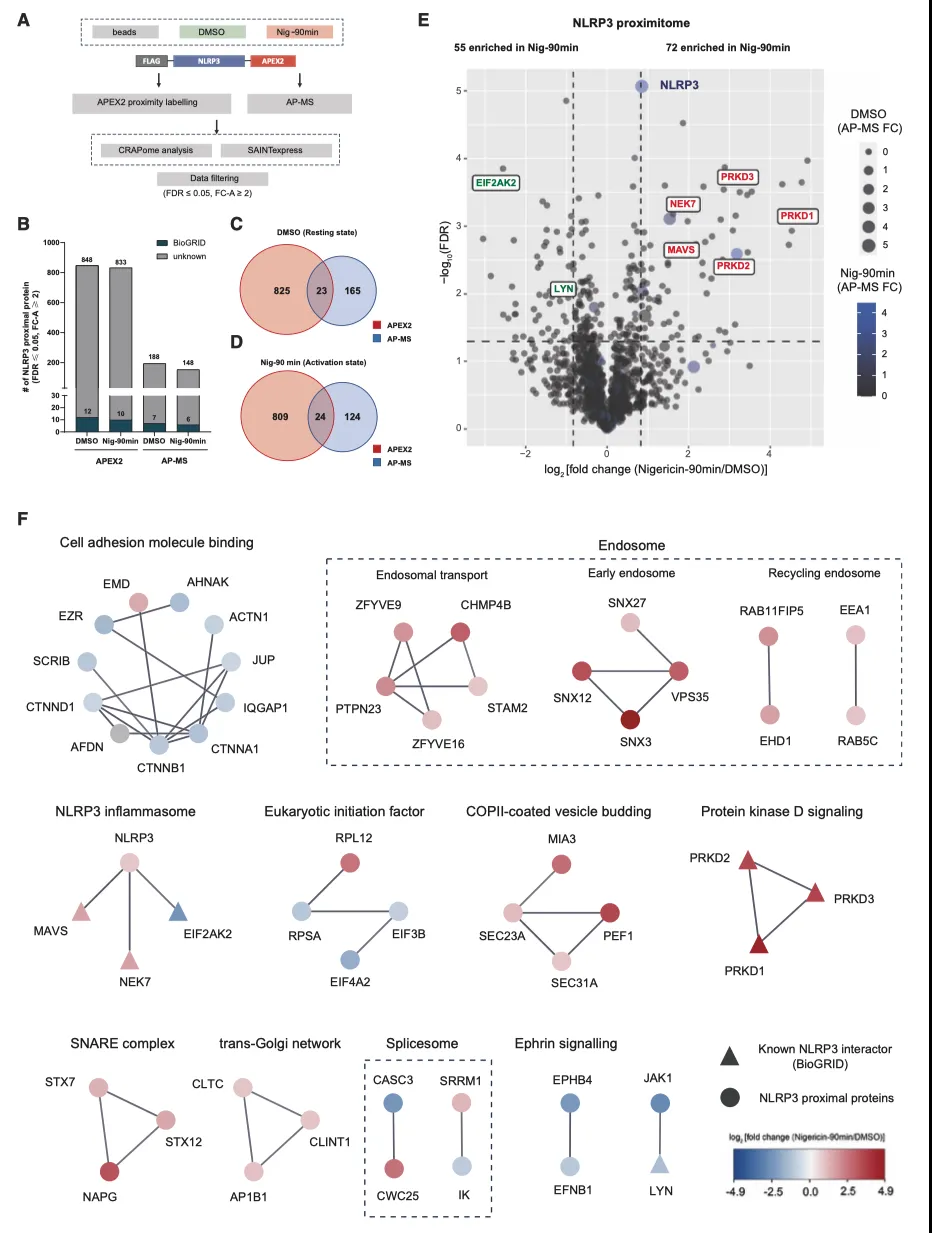
实验结果5
通过近距离蛋白质组引导的 RNAi 筛选确定与 NLRP3 相关的 DUBs
近距离蛋白质组使作者能够捕捉到通过严格筛选标准(SAINT概率大于0.8,FC-A≥1)的多个泛素系统成分,包括18个DUBs(USP9X、USP8、USP5、USP47、USP32、USP24、USP19、USP15、USP14、USP10、USP1、UCH-L1、PAN2、OTULIN、OTUID4、OTUB1、EIF3H和CYLD)。在这 18 个富集的 DUBs 中,有 9 个始终存在于所有四组中,而且在受刺激和未受刺激状态下没有明显差异(图 5A-5E )。作为补充,作者在光甘油 12-肉豆蔻酸 13-乙酸酯(PMA)分化的 THP-1 细胞中进行了 DUB 库 RNAi 筛选,目的是评估它们对 NLRP3 炎症小体启动和活化的影响(通过 IL-1β 的产生反映出来)。研究发现,总共敲除了25个DUBs(超出平均值±1个标准差的离群值,Z得分≥1或≤-1;表S3),它们改变了经LPS或LPS/尼日利亚菌素处理的THP-1细胞中的IL-1β水平(图5F和5G)。结合近距离蛋白质组学和 RNAi 筛选发现,有 7 个 DUBs 在两种试验中都显示了效应(USP9X、USP8、USP14、USP10、UCH-L1、OTUB1 和 OTUD4)(图 5H)。据报道,USP9X、USP14 和 OTUB1 可调节 NLRP3 炎性体35,36,这表明还有其他 NLRP3 相关 DUB(USP8、USP10、OTUD4 和 UCH-L1)。

实验结果6
UCH-L1 与 NLRP3 的 NACHT 结构域相互作用并影响 IL-1β 的产生
在这些 DUBs 中,UCH-L1 始终影响 IL-1β 的水平,并显示出较高的 NLRP3 接近度评分。值得注意的是,敲除 UCH-L1 不会改变前 IL-1β mRNA 的表达,但会降低 THP-1 单核细胞(图 5I 和 5J)和人外周血单核细胞(PBMCs)(图 5K 和 5L)的蛋白水平和成熟形式的产生。在 UCH-L1 缺失的情况下,IL-6 和肿瘤坏死因子α(TNF-α)的表达也受到轻微抑制,这表明 UCH-L1 也可能在核因子κB(NF-κB)调控的引物阶段发挥作用。由于 UCH-L1 在中枢神经系统相关细胞中含量很高,作者试图研究它在脑驻留免疫细胞(如小胶质细胞)中的作用,这些细胞也表达 NLRP3 炎性体成分。与 THP-1 细胞和 PBMC 类似,UCH-L1 的缺乏也明显抑制了人小胶质细胞系 HMC3 中 IL-1β 的产生(图 5M 和 5N)。
通过 NLRP3-APEX2 PL(图 6A)确定了 NLRP3-UCH-L1 的关联,并通过 HEK293T(图 6B)和 BV2 小胶质细胞(图 6C)中的免疫沉淀进行了证实。值得注意的是,在尼日利亚菌素刺激下,NLRP3 和 UCH-L1 之间的结合水平会降低(图 6B)。为了进一步确定 NLRP3 中哪个结构域与 UCH-L1 相互作用,作者在 HEK293T 细胞中过表达了 FLAG 标记的全长和截短 NLRP3。UCH-L1 与全长 NLRP3 和 NLRP3 的 NACHT 结构域相互作用(图 6D 和 6E)。这些结果表明,NLRP3 的 NACHT 结构域直接或间接地为 UCH-L1 提供了一个结合位点。此外,免疫荧光显示,在人诱导多能干细胞(hiPSC)衍生的小胶质细胞中,NLRP3与UCH-L1共定位(图6F和6G)。
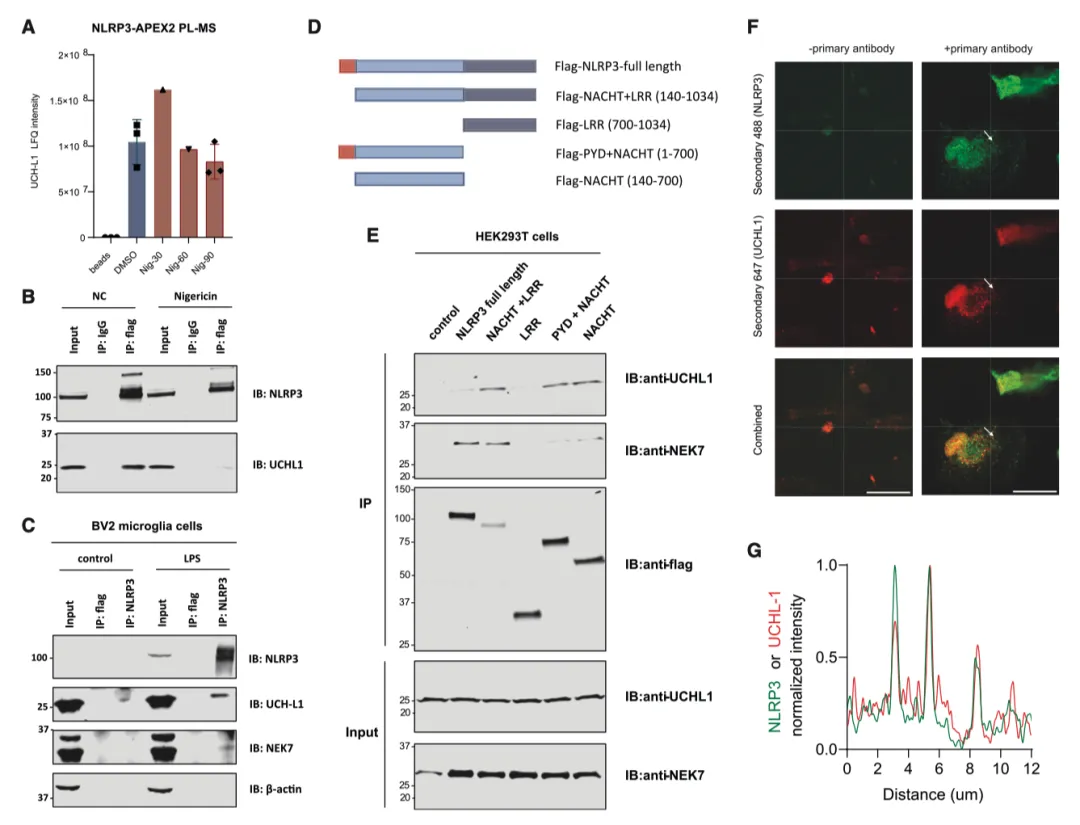
实验结果7
UCH-L1 催化抑制可抑制 ASC 组装、NLRP3 炎症小体激活和 IL-1β 处理
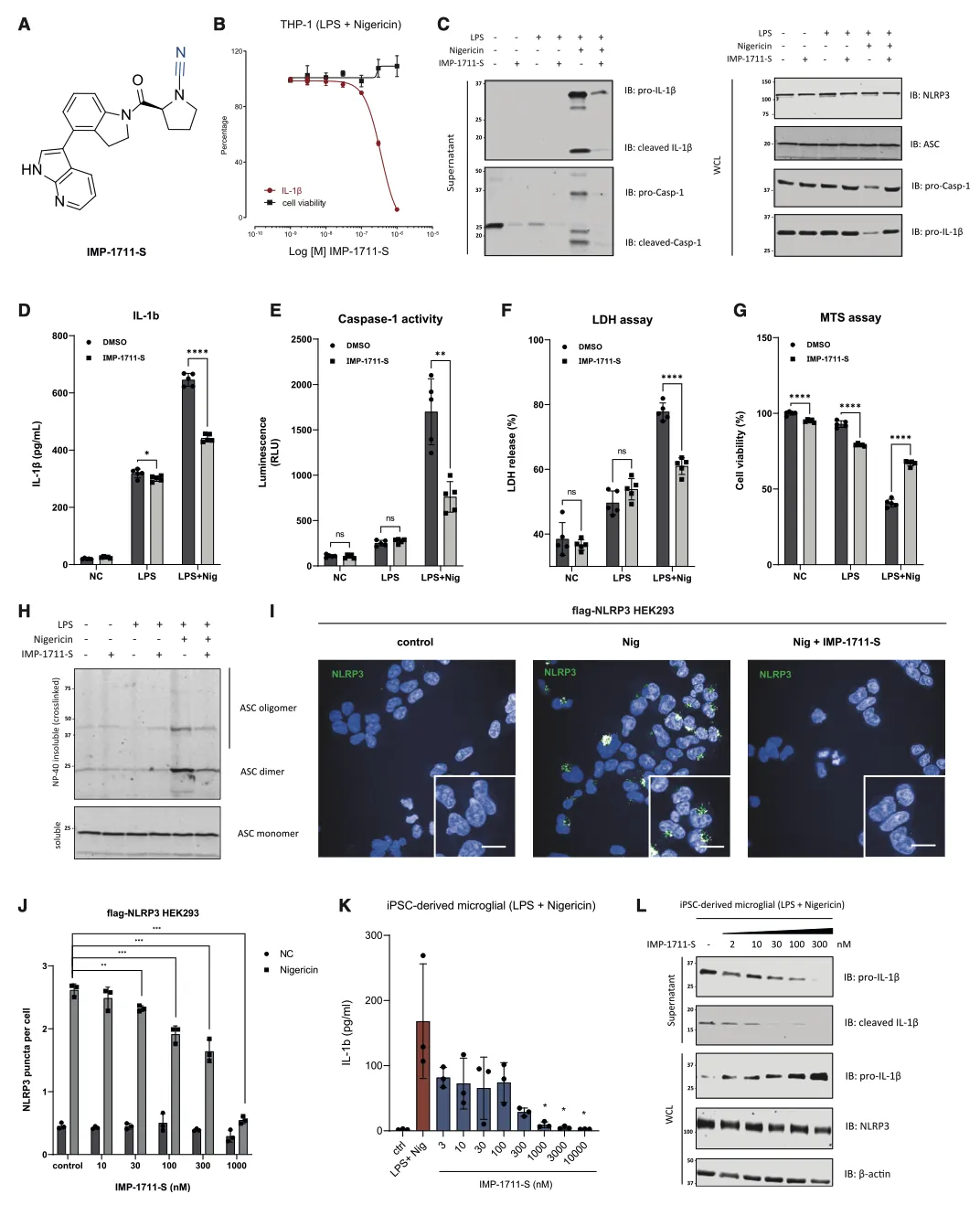
为了研究 UCH-L1 如何调节 IL-1β 的处理和释放,作者选择了一种强效抑制剂 IMP-1711-S(图 7A)并测试了它对 THP-1 细胞、人 PBMC 和源自 hiPSC 的小胶质细胞中 NLRP3 炎性体活化的影响。用 LPS 诱导细胞,用 IMP-1711-S 进行预处理,然后用 NLRP3 激活剂尼日利亚菌素刺激细胞。作者观察到,在 PMA 分化的 THP-1 细胞(图 7B)和 hiPSC 衍生的小胶质细胞(图 7K 和 7L)中,IMP-1711-S 以浓度依赖的方式抑制了 IL-1β 的产生。在 IMP-1711-S 处理的 THP-1 细胞上清液中,caspase-1 p10 和裂解的 IL-1β 水平都有所降低(图 7C-7E),这表明抑制剂对 caspase-1 和 IL-1β 处理阶段的活化产生了作用。IMP-1711-S 能有效抑制气体脱氢酶 D(GSDMD)的裂解、乳酸脱氢酶(LDH)的释放,并阻止 Nig 诱导的细胞自燃死亡(图 7F、7G)。此外,IMP-1711-S 处理不影响 LPS 刺激引物阶段裂解物中原天冬酶-1 或原 IL-1β 的表达(图 7C)。通过交联不溶性裂解物部分进一步研究 THP-1 细胞中 ASC 的寡聚化发现,虽然 IMP-1711-S 对细胞裂解物中 ASC 的表达没有影响,但它大大降低了 LPS 和 Nig 刺激后 ASC 的寡聚化水平(图 7H)。此外,在 HEK293 细胞中,IMP-1711-S 以浓度依赖的方式显著降低了 NLRP3斑点的形成(图 7I 和 7J)。作者的研究结果强调,抑制 UCH-L1 可通过破坏 NLRP3 组装和斑点的形成来阻碍 NLRP3 炎性体的激活,最终导致 IL-1β 的产生减少。