超级增强子是一种复合调控元件,可以控制关键细胞身份基因的表达。它们招募高水平的组织特异性转录因子和共活化子,如中介体复合物,并以高频率与目标基因启动子发生联系。大多数超级增强子包含多个组成调控元件,但目前尚不清楚这些元件在激活目标基因表达中是否具有不同的作用。此前,在Cell上发表的一篇题为"Super-enhancers include classical enhancers and facilitators to fully activate gene expression"的文章中,作者通过重建内源性的多部分α-珠蛋白超级增强子,展示了它包含了在生物信息学上等效但在功能上不同的元件类型:经典增强子和促进子元件。
促进子本身没有增强子活性,然而在它们缺失的情况下,经典增强子无法完全上调其靶基因的表达。没有促进子,经典增强子的中介体招募、增强子RNA转录和增强子启动子相互作用均减少。促进子可以互换使用,但根据它们在多部分增强子中的位置,存在功能层级。因此,促进子在增强经典增强子的活性和确保靶基因的强大激活中起重要作用。

图片摘要
背景
超级增强子(super-enhancer ,SE)是一种复合调控元件,可以控制关键细胞身份基因的表达。它们由经典增强子和促进子组成,共同发挥作用。研究发现,促进子对于经典增强子的活性起到了重要的增强作用,确保了目标基因的有效激活。
尽管对超级增强子进行了广泛的分析,但它们的真正性质仍然不清楚。目前的研究存在争议,无法确定超级增强子是独立的经典增强子群体还是包含不同功能元件类型的合作体。由于遗传解析SEs具有困难,很难将SE调控的基因表达变化与细胞谱系和分化的相关变化区分开来。因此,需要更严格的分析来确定超级增强子的真实本质。
小鼠α-珠蛋白超级增强子(α-globin SE,α-SE)是由五个元件构成的,它们与重复的α-珠蛋白基因位于一个特定的区域,并在红细胞分化过程中上调基因表达。之前的研究已经对α-SE进行了解析,发现它包含两个能够显著上调基因表达的经典增强子,以及三个没有增强子功能的元件。然而,这些研究并没有探究每个元件的充分性以及五个元件之间的功能关系。
作者通过工程改造小鼠α-珠蛋白超级增强子,重建了其结构并揭示了其中的复杂关系。研究发现,超级增强子由经典增强子和促进子组成,促进子对于增强经典增强子的活性起到重要作用。
实验结果
将小鼠α-珠蛋白超级增强子进行工程改造,作为超级增强子元件的测试平台
传统的编辑方法在单个等位基因中进行多个独立突变的工程改造耗时且复杂,需要多个步骤来确保精确性,并避免“非目标效应”。这可能会影响细胞正常分裂和分化,以及生成后续的小鼠模型的能力。
为了解决这些问题,作者采用了最新开发的大型DNA片段的全新组装方案,设计并合成了包含野生型α-珠蛋白亚-TAD或个别设计变体的86 kb等位基因。通过重组酶介导的基因组替代技术将这些等位基因整合到已经删除了整个α-珠蛋白基因座位的mESCs中(图1A),使得作者可以在每个新合成的基因座位上进行基因组分析。通过体外分化和红细胞纯化系统,作者对这些不同的红细胞进行了分析。

图1 构建无增强子(Δα-SE)的体外小鼠模型和仅含R2的体内小鼠模型,以测试R2增强子元件的充分性
在没有所有增强子的情况下,基因表达显著降低
在删除所有增强子的情况下(Δα-SE),来源于EB的红细胞几乎完全失去了α-珠蛋白的表达(丧失率超过99.9%),且与SE元件相关的所有染色质标记都消失(图1B,1C)。没有增强子时,整个基因座位上的H3K27Ac几乎完全消失,只有与胚胎ζ-珠蛋白基因相关的一个非常小的峰仍然存在(图1B)。Δα-SE模型为研究SE元件在红细胞生成过程中的作用提供了一个明确的基准。
仅有一个增强子驱动的α-珠蛋白基因座(R2-only)与α-珠蛋白表达的严重下调和胚胎致死相关
为了确定R2增强子对α-珠蛋白表达的个体贡献,作者将无增强子基因座(Δα-SE)与仅含R2的基因座进行了比较(图1A)。仅含R2的红细胞表达的α-珠蛋白仅为预期的10%,比预测值低了5倍(图1C)。
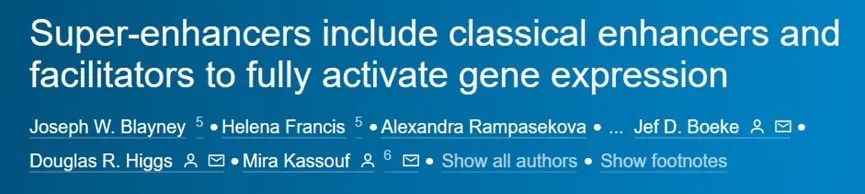
为了进一步研究仅含R2的表型,作者生成了一个仅含R2的小鼠模型,以替代内源性α-SE。与先前的ΔR2小鼠相比,仅含R2小鼠的存活率较低(图1D)。仅含R2小鼠出现了体型较小、苍白以及贫血和严重脾脏肿大的现象(图2A)。只有一个纯合体小鼠存活,但在7周时过早死亡。这些结果表明R2增强子在小鼠的生存和血液学表型中起着重要作用。
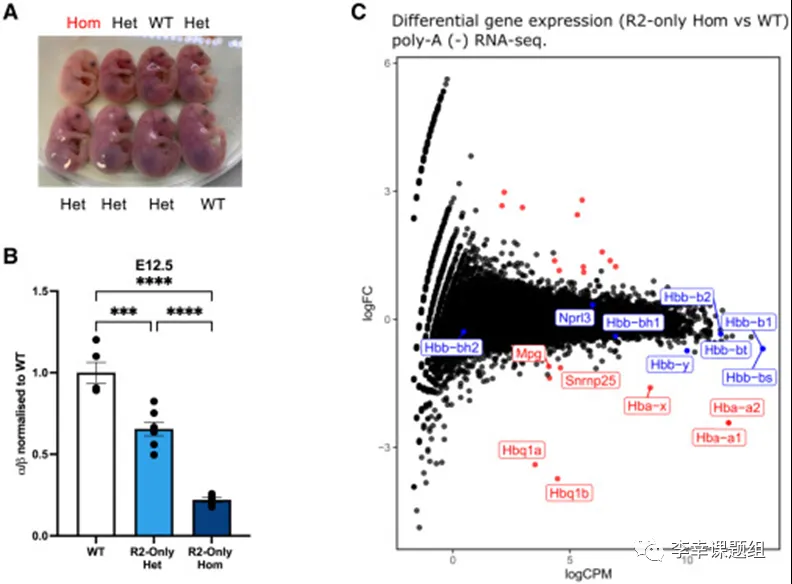
图2 仅含R2的小鼠表现出严重减弱的α-珠蛋白表达,并且无法存活
作者发现R2-only纯合体小鼠出现了严重贫血的症状。这表明,去除R1、R3、Rm和R4对于α-珠蛋白的表达产生了比预期更大的影响。为了排除其他因素的干扰,作者进行了一系列的实验和分析。首先,作者通过荧光激活细胞分选技术对红细胞群体进行了分析,结果显示R2-only红细胞群体的分化状态与WT同胞非常相似。这表明红细胞生成和细胞群体差异不是导致贫血的主要原因。为了进一步确认α-珠蛋白的表达情况,作者进行了RT-qPCR和RNA-seq实验。
令人惊讶的是,与预期的50%相比,R2-only红细胞仅表达了15%的α-珠蛋白(图2B)。这表明去除了R1、R3、Rm和R4对于α-珠蛋白的表达具有显著的负面影响。还观察到α-珠蛋白基因座上游的两个基因的表达下调(图2C)在其他SE元件缺失的情况下,R2元件保留了其增强子特性,但未能招募高水平的共激活元件
在其他SE元件缺失的情况下,R2元件保留了其增强子特性,但未能招募高水平的共激活子
经过去除R1、R3、Rm和R4后,作者对R2-only α-珠蛋白基因座进行了深入研究。作者发现,在R2-only FL红细胞中,R2和α-珠蛋白启动子仍然保持可及性,并且R1、R3、Rm和R4是基因组范围内变化最大的区域(图3A)。通过ChIPmentation实验,作者观察到R2和α-珠蛋白启动子上存在活性增强子和启动子相关的组蛋白修饰标记,尽管在R2-only模型中这些标记的水平明显受损。此外,作者发现R2能够招募红细胞特异性转录因子,形成开放的染色质区域(图3B)。尽管缺少α-SE中的其他元件,R2仍然保留了其作为增强子的特性,招募转录因子并创建开放的染色质环境。
为了研究R2在缺少其他α-SE成分的情况下招募共激活子的能力,作者进行了ChIPmentation实验。结果显示,在R2-only FL红细胞中,招募中介体复合物(Mediator Complex)成员Med1和含有溴结构域(bromodomain)的蛋白质 Brd4的水平明显降低(图3B)。此外,作者还观察到R2-only红细胞中,α-珠蛋白启动子上Pol II的占位也显著减少(图3B)。在没有其他α-SE成分的情况下,R2的共激活子招募能力受到了严重影响。
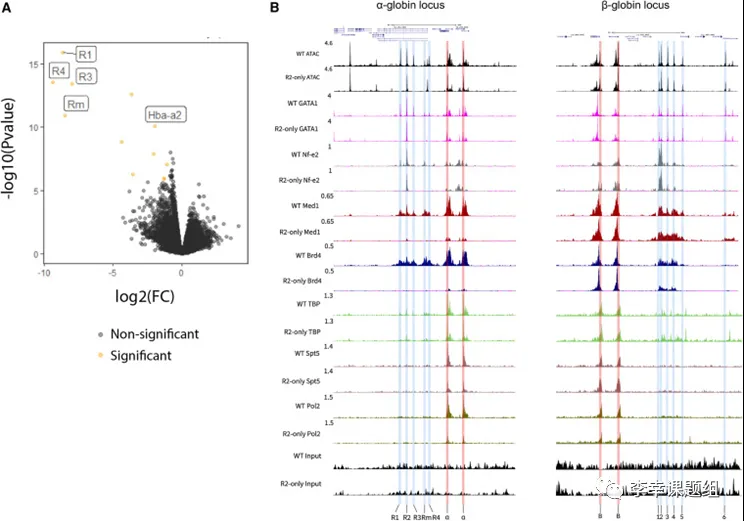
图3 在R2-only红细胞中,R2保留了活性增强子的特征,但共激活子的招募显著减少
在没有R1、R3、Rm和R4的情况下,R2的eRNA转录量减少了
增强子通常会进行活性转录,产生不同长度的双向转录本。研究发现,R2-only细胞中只有R2增强子显示出转录迹象,其他α-SE成分则没有。这表明R2在转录活性上保持了增强子的特征,而其他成分的缺失导致了转录的减少。关于转录与增强子强度之间的关系以及eRNA是否具有功能的问题仍然不清楚。
为了定量比较WT和R2-only细胞中的R2 eRNA转录情况,作者通过进行“虚拟qPCR”实验,作者发现在R2-only细胞中,与WT相比,R2 eRNA的转录量减少了约3倍(图4A)。
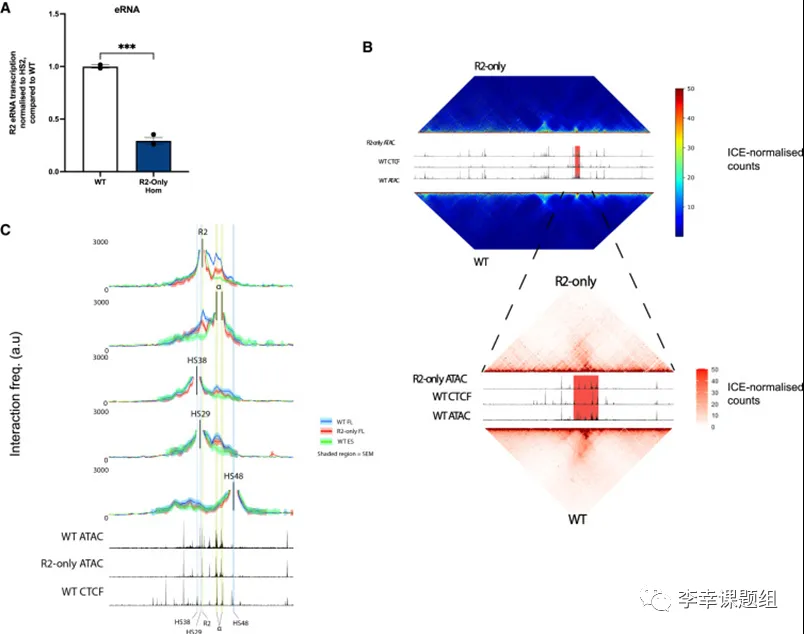
图4 在R2-only红细胞中,R2 eRNA的转录和R2-α启动子的相互作用频率都减少了
在缺少其他α-SE成分的情况下,R2-only基因位点中的增强子-启动子相互作用受到了影响
多项研究表明,增强子与目标基因之间存在高频率的相互作用。然而,这些相互作用的机制和与基因激活的关系仍不清楚。以前的研究发现,在红细胞中,特别是R1和R2成分,α-增强子经常与α-珠蛋白启动子发生相互作用。为了进一步研究在R2-only基因位点中R2与α-珠蛋白启动子的相互作用情况,作者采用了一种高分辨率的染色质构象捕获(chromatin conformation capture ,3C)技术,并对围绕α-珠蛋白的3.3 Mb基因组位点进行了比较。
染色质相互作用热图显示,在R2-only FL红细胞中,研究发现α-珠蛋白亚-TAD的染色质相互作用频率有所降低(图4B)。尽管CTCF位点与周围DNA的相互作用保持不变,但R2与α-珠蛋白启动子之间的相互作用频率显著降低(图4C)。不过,与WT mESC基线相比,R2-only FL红细胞中的相互作用频率仍然显著较高。这表明,R2元件在调节α-珠蛋白基因表达中起到重要作用,并且其他元件的缺失并未完全消除相互作用的发生。
α-SE的组成部分并不相等,并具有两种不同的功能
在R2-only小鼠模型中,R2增强子虽然保留了活跃增强子的特征,但其招募共激活子、与目标基因启动子相互作用、产生双向eRNA转录产物以及上调α-珠蛋白表达的能力都大幅减弱。为了确定其他SE元件的作用,作者使用了体外的mESC红细胞分化系统进行了不同配置的α-SE重建。
作者的初步结论是α-SE的组成具有叠加效应,这是通过从完整的SE中逐个删除元件的实验得出的。为了重新验证这些发现,作者在半合子mESCs中重建了相同的删除。结果显示,删除R1或R2显著降低了α-珠蛋白的表达,而删除R3、Rm或R4的影响不明显(图5A、5C)。这些结果进一步支持了作者之前的发现。
作者进一步研究了将α-SE的第二个主要激活子R1重新插入到无增强子的Δα-SE位点中的效果。然而,即使同时存在两个主要激活子的模型(R1R2-only),也无法恢复高水平的α-珠蛋白转录(图5A)。
作者发现,尽管R3、Rm和R4元件几乎没有传统增强子的活性,但它们似乎仍然对完整的α-SE活性至关重要。作者将其称为“促进子”。为了研究R3、Rm和R4如何与R1和R2相互作用,作者生成了一个“增强子滴定系列”,逐步重建了原始的α-SE,并生成了所有R3/Rm/R4的排列组合(图5B)。
作者为每个模型生成了多个克隆,并通过PCR和Sanger测序验证了它们的完整性。使用JASPAR、Sasquatch等计算工具进行了预测,确认新设计的模型没有意外地创建具有潜在功能的序列。通过ATAC-seq实验证明,在每个模型中,与相应元件相关的染色质在红细胞中变得可及性,并且整个位点的可及性没有意外的改变(图5C)。
作者重新插入了促进子(R3、Rm和R4)到仅含有R1和R2的基因中,以评估它们增强经典增强子的能力。结果显示,将R3元件重新插入到R1R2-only背景中仅能使基因表达增加约10%(无统计学显著性),而重新插入Rm或R4则有更显著的效果,分别使R1R2-only的表达增加了50%和80%。此外,重新插入R4元件还导致H3K27Ac在R1和R2元件上的显著增加,表明R4的主要作用是促进两个经典增强子的完全活性(图5D)。
将R3元件重新插入时,无论存在Rm、R4或两者,都能使α-珠蛋白转录上调到大致相同的程度。然而,在包含R4的基因簇中重新插入Rm的效果较小,反之亦然。因此,Rm和R4在促进经典增强子R1和R2功能方面似乎有部分重叠,其中R4的效果比Rm更强。

图5 为了发挥其全部潜力,R1和R2增强子依赖于R3、Rm和R4元件
R4的救援潜力取决于其位置的特定性
为了探究R4具有更强救援潜力的原因,作者重新分析了DNase-seq数据集,并对五个α-SE元件进行了基序分析。结果显示,R1和R2含有最多的转录因子基序和复杂的DNase足迹信号。然而,与Rm和R4相比,R3含有更多的红细胞转录因子基序,这也得到了DNase足迹信号的支持(图6A)。虽然可能存在其他未知子的参与,但作者的数据表明,R3、Rm和R4的救援能力并不仅仅取决于它们招募转录因子的能力。
R3、Rm和R4的救援能力与它们与α-珠蛋白启动子之间的距离呈负相关。通过重新插入R4到不同位置的模型中,作者发现R4的救援能力不仅仅取决于其序列,而且与其与启动子的距离密切相关(图6B)。
为了测试元件位置的重要性,作者在R1R2-only模型中插入了R3,并显示了再插入位点的可及染色质。结果显示,将R3移动到靠近α-珠蛋白启动子的位置对基因表达产生了显著影响,相比于R1R2-only模型中R3在其原始位置上的救援效果约为12%,在R1R2R3[R4]模型中基因表达增加了超过85%(图6C)。这强烈表明R4的位置,而不是其序列,对其在救援基因表达方面的效力起着决定性作用。
R2-only FL红细胞中,R2与α-珠蛋白启动子之间的相互作用频率降低。作者猜测R4在增加α-SE与启动子之间的相互作用频率方面可能发挥作用。为了测试是否通过减少R2与启动子之间的线性距离可以救援R2-only的转录缺陷,作者将R2插入到R4的位置,但令人惊讶的是,将R2靠近启动子并没有对基因表达产生积极影响(图6D)。这表明,仅仅通过物理上的线性接近无法完全恢复R2的活性。

图6 R3、Rm和R4的相对活性主要由它们的位置所决定
在其他多部分增强子中识别促进子
作者探讨了其他多部分增强子簇是否含有与定义的促进子相似的元件。通过对β-珠蛋白LCR中的HS1元件进行研究,发现尽管其缺乏内在的增强子活性,但在α-珠蛋白基因座上表现出了促进子的特征。实验结果显示,将HS1放置在α-珠蛋白促进子的位置,像α-珠蛋白促进子一样,它显示出对R1R2等位基因的显著救助潜力,观察到α-珠蛋白表达的36%增加(图6E),尽管比原生促进子的救助效果较低(Rm约50%和R4 >80%)。这项研究为进一步了解促进子的作用提供了重要线索。
讨论
自从1981年首次描述增强子元件以来,对增强子的研究已经非常广泛。尽管增强子簇已经被研究了四十多年,但作者仍然对其活动的基本原则了解有限。各种类型的增强子簇被报道,其中包括超级增强子等。作者选择研究超级增强子是因为它们具有明确定义和广泛应用的特点。尽管如此,作者仍然认识到不同的增强子簇可能有不同的作用机制。
超级增强子(SE)具有高水平的H3K27Ac修饰、转录因子和调节子结合,以及成分之间有限的基因组距离。尽管已有许多研究证明SE能够激活高水平的基因表达,但目前对于SE与普通增强子簇之间的功能区别仍不清楚。研究发现,SE可能以不同的方式组合,有的是加法式的,有的是非加法式的。然而,由于研究中的限制,对SE的解剖研究仍不完全。此外,SE对目标基因的影响可能在不同基因座之间有所差异。
在这项研究中,作者对α-珠蛋白超级增强子进行了全面的解剖,以研究其五个成分之间的合作方式。研究发现,其中的一个成分R2并不能单独实现增强子的完整潜力,而需要其他四个成分的配合。尽管R2保持了活性增强子的特征,但其单独作用并不能达到高水平的α-珠蛋白表达。
重新构建α-珠蛋白超级增强子揭示了五个成分之间的复杂合作关系。先前的单个删除模型无法完全解释这种合作。研究表明,R1和R2具有协同作用,而R3、Rm和R4则促进了R1和R2的活动。
研究发现,在基因组中可能存在类似的促进子元件。对MYC超级增强子的研究显示,其中四个成分在HepG2细胞中没有可检测到的增强子活性。类似地,其他研究也发现了类似情况,一些元件虽然自身增强子活性较弱,但对整体增强子的功能却至关重要。这些发现表明促进子可能是超级增强子的普遍特征。
目前尚不清楚促进子如何增强超级增强子的活性。研究表明,促进子可能通过提供转录因子或共同子的招募或稳定性的协同作用来发挥作用。此外,促进子和增强子的适当位置可能会结合形成特定的三维结构。有趣的是,促进子的层次结构更多地取决于它们的位置而不是序列。最近的研究还发现,在果蝇中存在类似的元件,它们不是增强子,而是通过将调控元件相互连接来促进它们之间的相互作用。
一些研究表明,增强子簇(包括超级增强子)可能通过协同作用形成含有高浓度的组织特异性转录因子、共激活子和RNA聚合酶II的聚焦区域。这些亚核结构的形成机制目前存在争议,但液-液相分离和转录因子捕获等理论被提出。这些理论都需要在特定的三维空间内招募足够数量的转录因子。研究发现,通过增加转录因子结合位点密度,R4能够恢复基因表达,而R2则无法实现。
总的来说,作者的研究结果表明,超级增强子可以形成复杂的调控元件网络,展现出协同、冗余和协同增强的功能。作者的研究提供了证据,支持超级增强子由经典增强子和促进子相互作用而产生的新特性。

















