哺乳动物寿命的缩放定律(Scaling Law):DNA 甲基化从年轻状态漂移的速度(Methylation drift rate:DNA甲基化变化积累的速度)与最长寿命密切相关。

Scaling Law( 尺度定律或者缩放定律)是一种数学关系,它描述了一个系统的某些特性如何随着系统的规模或尺寸的变化而变化。在不同领域,尺度律表现为不同的形式,但通常它可以表示为一个幂律关系。如心率与体型的关系: 心率与体型之间也存在尺度律关系。通常,较小的动物心率较快,而较大的动物心率较慢。这种关系也可以用幂律来表示。再比如,较大的动物平均寿命比较小的动物更长:寿命遵循动物体型的幂律。缩放定律的确定往往有助于深入了解将这两个量联系起来的过程。就体型和寿命而言,这一过程就是捕食:体型较大的动物捕食者较少,更有可能存活到较老的年龄,这使得抗衰老适应有利于生物体的适应性。尽管体型提供了一个解释寿命的生态学依据,但它并没有为寿命的分子方面提供任何见解。另一方面,DNA甲基化是一种已知与衰老密切相关的表观遗传标记,但直到最近,它还没有与生物体的寿命联系起来。最近的研究—Crofts等人的研究,发表在《Nature Aging》上,以及Horvath等人的预印本研究—发现DNA甲基化从其年轻状态积累速率与哺乳动物的寿命密切相关,从而确定了一种缩放定律。
DNA甲基化和表观基因组(Epigenome)在衰老过程中有着密切的关系。表观基因组包括DNA和组蛋白的化学变化,这些变化决定了基因组DNA在细胞核内的折叠方式,并调控在特定细胞中哪些基因组部分被表达。这使得生物体内的细胞能够分化成不同的组织,并对环境刺激做出反应。从酵母到人类的多种生物研究发现,当生物体衰老时,它们的表观基因组会逐渐偏离其年轻状态。
DNA甲基化是一种表观遗传标记,它由在CpG二核苷酸上的胞嘧啶共价添加甲基基团构成。Horvath和Hannum等人在2013年发表的研究发现,DNA的甲基化状态可以非常准确地预测人类捐献者的年龄。自那时以来,这一发现已经在其他几种物种中得到了重复验证,这表明DNA甲基化的改变是衰老的一个方面,在进化过程中是保守的。至于这些变化的累积速度是否会对最长寿命构成进化限制或与之相关联,目前还不得而知。在Horvath和Crofts等人的最新研究之前,其他研究也报告了寿命与甲基化漂移之间的关联。最近,Bertucci-Richter和 Parrott 发表的一篇文章发现,在寿命较长的物种中,DNA 甲基化模式发生紊乱的速度较慢。尽管这些研究富有启发性,但它们要么只比较了少数物种,要么专注于相对相似的物种。更为重要的是,建立这种缩放定律充满了潜在的统计学陷阱。如果不加以处理,这些陷阱很容易模糊缩放定律,甚至凭空创造出一个“明显的”缩放定律。
例如,Crofts等人通过模拟发现,即使是具有相同DNA甲基化漂移速率的物种也可能表现出显著不同的漂移速率。这是因为在寿命最短的动物一生中,快速漂移的CpG位点达到了完全甲基化(或未甲基化)状态,这使得寿命较长的物种的漂移速率看起来要慢得多。另一个考虑因素涉及如何选择CpGs 进行漂移率比较:在衰老过程中,只有一部分CpG位点会发生甲基化变化,并且这部分位点在不同物种中有所不同。此外,基于年龄相关性预先筛选CpG位点可能会引入与每个物种可用年龄范围相关的偏差。
为了解决这些问题,Crofts等人和Horvath等人分别开发了两种不同的统计框架。Crofts等人的解决方案基于寿命相似物种的成对比较,在相同的范围内,聚焦于与年龄相关的CpGs。这一解决方案消除了对饱和CpGs的担忧,并且对定义与年龄相关的CpGs所使用的阈值不敏感。另一方面,Horvath等人的方法则避免了基于年龄相关性预先筛选CpGs,并进一步调整了不同物种间的年龄分布差异。此外,Horvath等人的方法通过染色质状态对CpGs进行了分类,以探讨寿命是否与特定调控元件处的甲基化漂移相关联。
随后,两种方法都应用于由哺乳动物甲基化联盟提供的庞大数据集:Crofts等人分别分析了来自42个物种的血液和皮肤数据,而Horvath等人则在分析中包含了125个物种,并为所有组织生成了一个单一的缩放定律。尽管方法存在差异,Crofts等人和Horvath等人都得出了相同的显著结论:较长寿物种的DNA甲基化从其年轻状态漂移的速率要慢得多—如人类和鲸鱼与老鼠相比,其漂移速率几乎可以忽略不计(图1a)。令人印象深刻的是,缩放定律即使对于那些根据其他长寿缩放定律看似异常的物种(例如小而长寿的裸鼹鼠),也能非常吻合数据。此外,Horvath等人发现,并非所有染色质状态下的漂移都与寿命呈现比例关系,但最显著的关联出现在双效启动子处。这一缩放定律的发现将引发对其背后原因的探讨。如此强的关系表明,DNA甲基化的稳定性可能会限制寿命,或者存在第三种未被观察到的过程同时影响DNA甲基化漂移和寿命。
当细胞分裂时,DNA甲基化标记必须被复制到新合成的链上。如果这个过程不准确,可能会发生“表观突变”;这使得细胞增殖显然有可能导致漂移率。因此,Crofts等人提出了一个模型,认为长寿物种经历较慢的甲基化漂移是因为其干细胞复制速率较慢,和/或因为它们进化出更好的机制来维持年轻的甲基化状态(图1b)。这一观点得到其他类型损伤(如突变)在分裂细胞中更快积累的事实支持。另一方面,长寿的哺乳动物往往体型较大,这可能意味着需要更多—而不是更少—的干细胞分裂来维持大体型。此外,许多CpGs在整个寿命中维持稳定的甲基化水平,因此,考虑到细胞复制对所有CpGs的作用相同,就会产生为什么只有一些CpGs会漂移的问题。
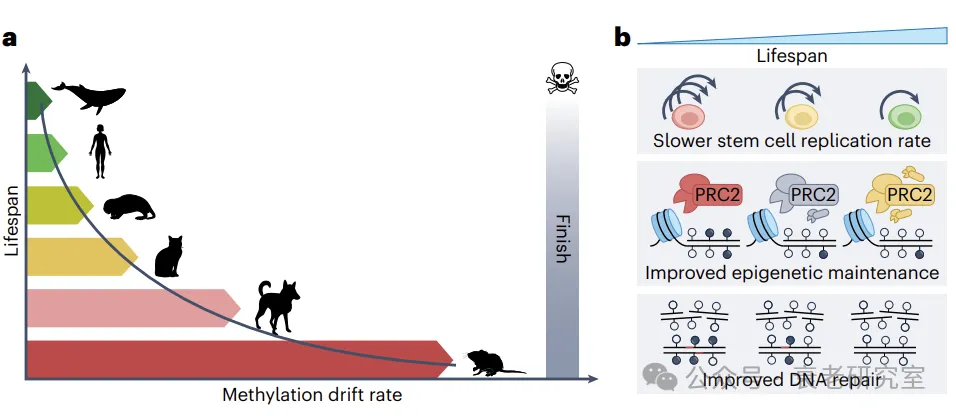
长寿物种进化出更优越的甲基化维护机制的假设似乎更为合理。这一假设也与突变率与寿命呈比例关系的发现一致。此外,Horvath等人的研究结果表明,漂移只在特定的染色质状态(如PRC2结合的双效启动子)与寿命成比例关系,这暗示着在进化过程中,长寿物种需要在这些地点得到更好的维护。双效启动子通常处于低甲基化状态,并且在衰老过程中特别容易获得甲基化。这可能意味着双效启动子(及其他特定染色质状态)的异常甲基化直接损害细胞功能(限制寿命),长寿物种可能已经通过调节PRC2复合体的活性来适应,以稳定双效启动子的甲基化。这种进化适应可能包括关键表观遗传调控因子的高表达、改善的酶活性或影响蛋白质相互作用的变化,从而导致更好或不同的结合伙伴招募。毕竟,类似的适应已经在其他类型的细胞损伤(如双链DNA断裂)中被观察到。事实上,长寿物种中改进的DNA修复能力可能解释了突变和甲基化漂移缩放定律:在DNA修复过程中,甲基化标记也会发生变化,并且在修复完成后必须被准确恢复。因此,DNA修复后甲基化模式的不完全恢复可能会导致甲基化漂移。
根据这一讨论,未来的研究可能希望调查 DNA 甲基化漂移的差异在多大程度上可以用复制率的差异来解释。Crofts等人在分析血液和皮肤样本时发现了其缩放定律的差异。因此,随着更多数据的获得,我们有兴趣探究在细胞复制速度较慢的组织(如大脑)中,缩放定律是否更弱。相反,比较生物学方法可用于确定表观遗传复合物(尤其是PRC2)的可能适应性,从而解释缩放定律。通过比较生物学方法发现导致更好地维持DNA 甲基化的特定分子适应性,将为减缓甲基化漂移和延长人类寿命的干预措施提供新的目标。如果甲基化漂移确实是衰老的原因,那么通过减缓甲基化漂移,我们或许可以针对衰老过程中的诱因进行干预。另一个悬而未决的问题涉及用于确定缩放规律的CpGs 的选择。可以说,用于生成这两项研究中所有CpG 甲基化数据的Horvath 哺乳动物甲基化阵列是基于数量有限的保守CpGs,这可能会产生偏差。鉴于Crofts 等人和Horvath 等人都正确地认识到CpG 选择是偏倚的潜在来源,未来的研究可以利用全基因组或减少代表性的亚硫酸氢盐测序来探索缩放定律在更广泛的基因组背景下的表现(尽管这将构成相当大的经济挑战)。令人欣慰的是,Bertucci-Richter和 Parrott 的观察结果表明,甲基化模式在长寿物种中的紊乱程度增加得更慢,而这一观察结果是通过减少代表性的亚硫酸氢盐测序数据得出的。因此,Crofts等人和Horvath 等人的缩放规律也很可能适用于更广泛的基因组环境。此外,还可以利用全基因组数据来研究受年龄影响的CpGs 数量是否也会随着寿命的延长而增加。
总之,Crofts等人和Horvath等人的研究作出了一个引人注目的发现,这无疑将为长寿进化提供关键的见解。

















