临床三期在研的抗体列表如下:
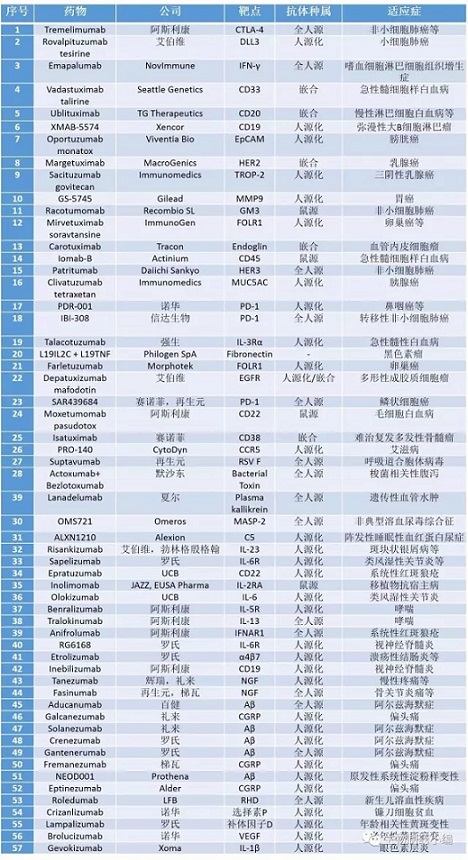
从项目归属来看,有24个项目不属于我们通常认为的制药巨头,而是由小型制药企业或生物技术公司开发;大企业主导的项目略占多数,但其中一部分是自主研发(如百健的Aducanumab、罗氏/Genentech的Etrolizumab等),另一部分是早期从小型公司或研究机构购买(如阿斯利康的Tralokinumab)。
可见,一方面,小型企业是抗体药物早期研发的主力,大企业如罗氏、阿斯利康等通过旗下专注研发的子公司进行早期研发,但整体来说,大企业创新不够;另一方面,抗体后期研发并不全集中到大企业,小型企业若有足够的资金,并能胜任临床研究,也可以将项目一直推进。当然,随着未来的一系列项目和企业并购,这些散落的项目可能最终会集中到制药巨头们的手里,就跟我们看到的已获批的抗体药物的所有权格局一样(见附录1和附录2)。
处于上市申请阶段的抗体列表如下:
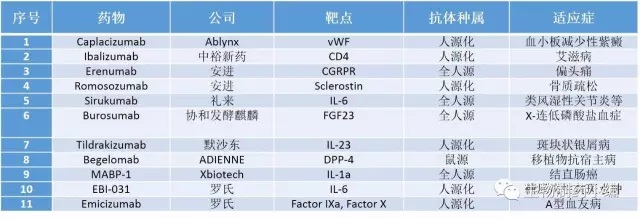
有几个药物值得关注:
Caplacizumab是Ablynx独立开发的纳米抗体,用于致死率较高的血小板减少性紫癜的治疗。该药与2009年获得FDA和EMA的孤儿药资格,今年2月向EMA申请上市。如果获批上市,Caplacizumab将是第一款针对该疾病的药物。
Ibalizumab最早由唐南珊和张子文创办的Tanox开发,是一款靶向T细胞表面CD4的抗体药物。2007年Tanox被Genentech收购后,Ibalizumab(TNX-355)被卖给台湾宇昌生技(现中裕新药)进一步开发(TNB-355)。目前中裕新药已经就Ibalizumab向FDA申请BLA。另外,中裕新药作为专注抗艾滋病药物开发的企业,其研发管线中拥有TNB-355的静脉注射和肌肉注射两种给药形式,还有基于TNB-355的改进版TMB-360/365、TMB-ADC和TMB-Bispecific,另外还有小分子药物TMB-607。
Erenumab是安进自主研发的靶向CGRPR的单克隆抗体药物,5月份申请BLA并在7月获得受理。首先,Erenumab的靶点是GPCR蛋白,若能获批,它将是继协和发酵麒麟的Mogamulizumab之后第二个获批上市的靶向GPCR蛋白的抗体药物;其次,Erenumab的适应症是偏头痛,这是一个患者群体较为广泛的病症,且高度致残,而且没有理想的治疗方法。该药的研发很有意义,只不过,面临的竞争不小。
Romosozumab也是由安进研发,用于妇女绝经后骨质疏松等适应症的治疗,它是安进继2010年获批的Denosumab后的又一款有骨质疏松适应症的抗体药物。不过由于心脏毒副作用,Romosozumab的第一次申请被FDA拒绝,安进与合作方UCB正在推进后期临床试验以证明该药物具有正向的风险/获益比。
Emicizumab是罗氏控股子公司中外制药研发的一款针对A型血友病的药物,模拟凝血因子VIII,同时结合靶向IXa因子和X因子,促进两者结合和X因子的激活,从而起到促凝血的作用。由于该病的患者不在少数(据罗氏官方宣称,全球范围内约32万人),且其中50-60%的人有严重症状,因此Emicizumab的开发意义重大。
与2017年以前获批的抗体药物的比较
由于时间距离较近,2017年获批的抗体(见附录1)将被与以上70个药物合并到一起,做为一个整体,与2017年之前获批的药物(见附录2)进行对比分析。
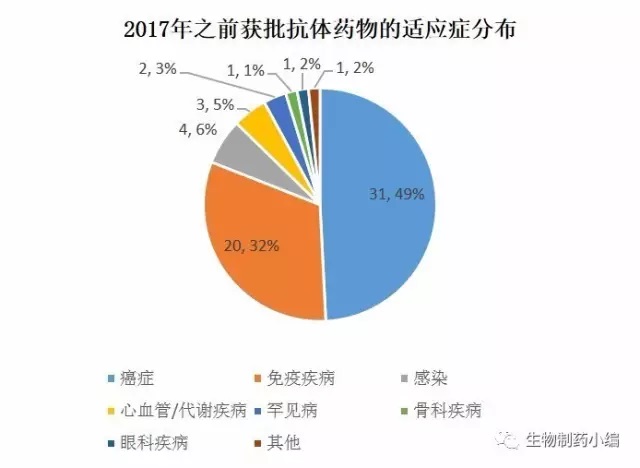
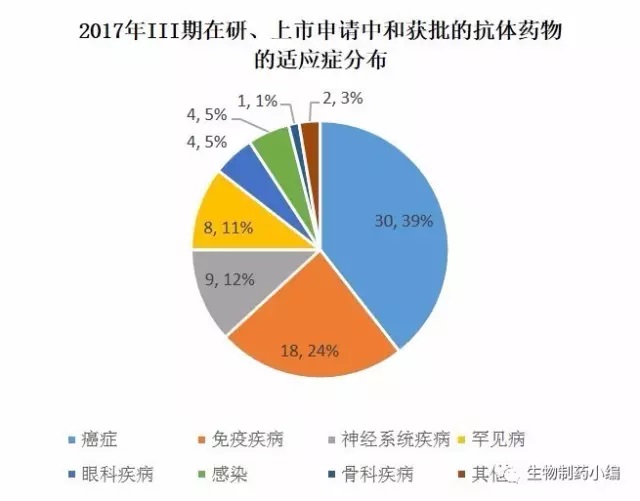
从适应症的分布来看,癌症和免疫疾病依然是主流,但相对比例有所缩小,体现了抗体药物研发向多个适应症领域开拓的趋势。其中变化比较明显的神经系统疾病和罕见病。
神经系统疾病有关的抗体药物有9个,适应症主要是2个:阿尔兹海默症和偏头痛。阿尔兹海默症已经多年没有新药上市,市场空缺严重,如果有抗体药物获批,不仅是第一个获批的针对该适应症的抗体药物,也将因填补市场空白而获得巨大的商业收益。偏头痛也是没有理想的治疗药物,市场空间很大,但竞争也很激烈。安进的靶向CGRPR的Erenumab目前走在最前面,但后面紧随着礼来的Galcanezumab、Alder的Eptinezumab和梯瓦的Fremanezumab(这3者靶向CGRP),孰优孰劣暂无法肯定。
罕见病相关的抗体有8个,相比于过去的30年共上市2个,增长较快,这得益于人们对罕见病的认识加深、重视度增加,更得益于抗体药物领域的蓬勃发展。这8个抗体针对的罕见病集中在血液病领域,包括A型血友病、遗传性血管水肿等。
抗体种属比较:鼠源抗体和嵌合抗体有所减少,人源化和全人源抗体各占半壁江山
由于ADC的抗体部分使用的是已上市的抗体药物,因此计算抗体药物种属分布时剔除ADC以避免重复计算。
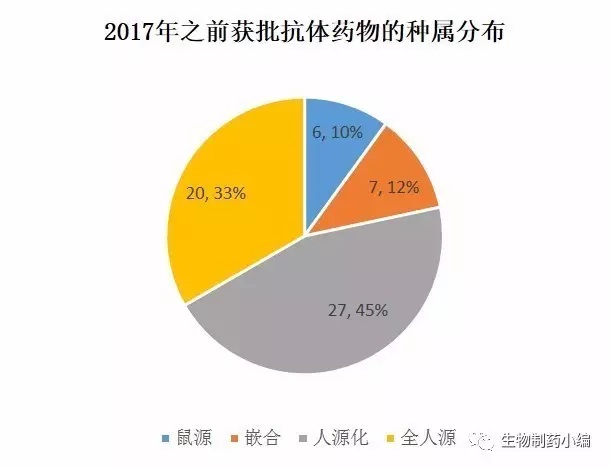
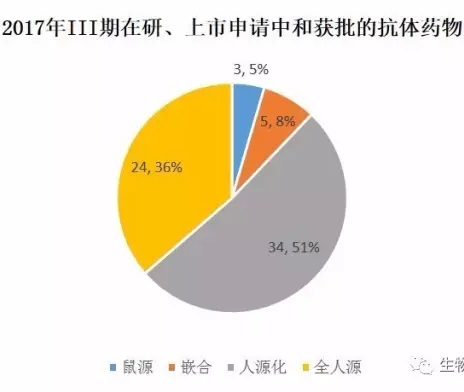
比较看来,鼠源和嵌合这两种形式的抗体数目和比例在减小,人源化抗体和全人源抗体已成为绝对主流。其中,全人源抗体一部分源于各公司的phage display筛选平台,一部分则源于XenoMouse、Humab mouse、KM mouse这些人源化小鼠的稳定输出。
Phage display的优势是门槛和成本较低,可以快速、大量地做早期筛选;人源化小鼠由于技术难度和专利原因,目前掌握在少数公司手里。关于这两种方法哪个更有优势,业界一直在讨论中,不过有一点可以肯定,短期内不会有一个完全取代另一个的情况发生。
抗体结构比较:ADC数目明显增加
2017年之前全球范围内共有4个ADC获批(Adcetris、Kadcyla、Mylotarg和Besponsa),其中Mylotarg于2010年撤市。而2017年之后的临床后期产品线上,有9个ADC药物,看得出ADC虽然由于其技术的复杂性而一直相对小众,但相比之前的若干年,已经走出低谷、逐渐升温。
总结
做一个简单展望,主要是2点:
适应症方面,癌症和免疫疾病由于患病群体巨大,细分领域众多,未来仍将是抗体研发的主要方向,其他疾病领域包括罕见病领域,会被逐步渗透。
技术方面,phage display和人源化小鼠依然会是早期筛选的基本平台,其他的新技术多数应该是基于这两个平台所做的改进和辅佐。
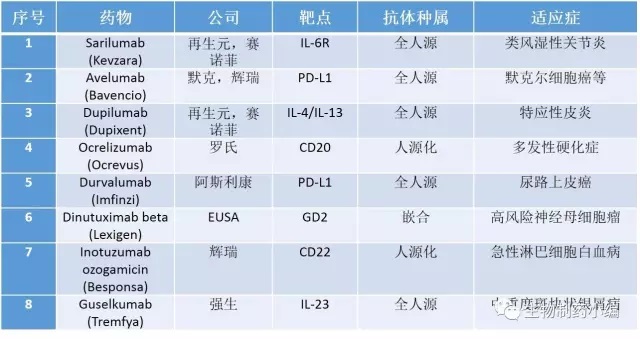
附录1: 2017年1月1日至8月27日全球范围内获批的单克隆抗体药物(融合蛋白等除外)
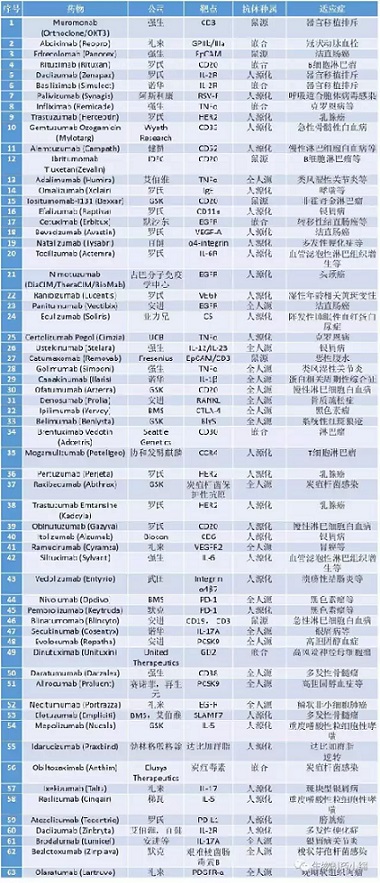
附录2:截至2016年底全球范围内获批的单克隆抗体药物(融合蛋白等除外,包含已撤市药物)
参考资料
-
Antibodies to watch in 2017.
-
Current progress in innovative engineered antibodies.
-
药渡、Drug Spider等数据库
-
各公司官网

















