这两篇论文出炉后,立刻引起了科学家们的热议。人们也终于意识到,平时在动物体内不起眼的微生物,竟然在癌症治疗上有着如此重要的作用。不过,也有一些科学家对这些结果报以怀疑。他们认为,尽管这两项研究很有趣,但这毕竟只是小鼠实验。真的要宣布这是重量级发现,至少也得在人体里重复了才行。
今天,人体研究的结果终于出炉!在《科学》最新上线的研究中,科学家们证明肠道菌群的确会影响免疫疗法对人类肺癌、肾癌、以及皮肤癌的疗效。这样能“验证概念”的重量级论文,一发就是两篇!

▲这样的重量级论文,一发就是两篇!(图片来源:《科学》)
在第一篇论文里,来自法国的一支研究团队分析了249名接受过抗PD-1免疫疗法的患者,他们患有肺癌、肾癌等多种不同的癌症。其中,在免疫疗法治疗前或者刚开始时,有69名患者接受了抗生素的治疗,用于预防牙科手术后的感染、治疗尿道感染、或是其他常规用途。理论上说,这些患者体内的肠道菌群在抗生素的作用下会出现紊乱。这会影响到免疫疗法的疗效吗?
结果令人震惊!研究发现,这些使用抗生素的患者,癌症很快就出现了复发,他们活的时间也更短!这表明抗生素的使用,极大影响了免疫疗法的效果。
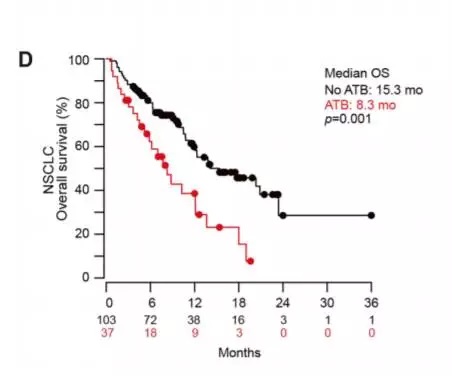
▲接受广谱抗生素的肺癌患者(红线)活得更短(图片来源:《科学》)
为了找到背后的机制,这支团队进一步比对了两组患者的肠道菌群。他们发现,在那些恢复较好的患者体内,有一种叫做Akkermansia muciniphila的益生菌。先前,人们发现它有预防肥胖和糖尿病的作用。没想到,它竟然对癌症免疫疗法还有促进作用。
后续研究也证实了这种益生菌的效果。首先,研究人员将这些患者的粪便植入到了没有肠道菌群的无菌小鼠体内,那些接受了“起效者”粪便的小鼠对于PD-1抑制剂的反应要明显优于接受了“无效者”粪便的小鼠,这再次验证了肠道菌群对免疫疗法的决定性作用。更重要的是,后者在口服Akkermansia muciniphila后,能恢复对免疫疗法的反应!
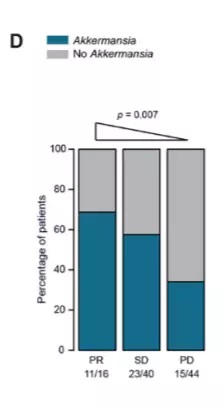
▲Akkermansia muciniphila与疗效相关(图片来源:《科学》)
第二篇论文则把皮肤癌这种看似和肠道毫无关联的疾病与体内微生物联系了起来。来自MD安德森癌症中心的研究人员分析了罹患转移性黑色素瘤,且接受了抗PD-1免疫疗法的患者粪便,并用16S RNA与全基因组测序的方法,来统计这些患者粪便中微生物的多样性。他们发现,免疫疗法起效的30名患者,和不起效的13名患者,肠道菌群有着显著不同!
那些肠道菌群更多样的患者,疾病没有出现进展的生存期(PFS)中位数为232天,显著高于肠道菌群不多样患者的188天。前者体内的瘤胃菌(Ruminococcaceae)较多,带有柔嫩梭菌(Faecalibacterium,一种瘤胃菌)的患者无进展生存期显著更长。而后者体内的拟杆菌(Bacteroidales)更丰富,拟杆菌最丰富的那批患者,无进展生存期会出现显著下降(188天 vs 393天)。
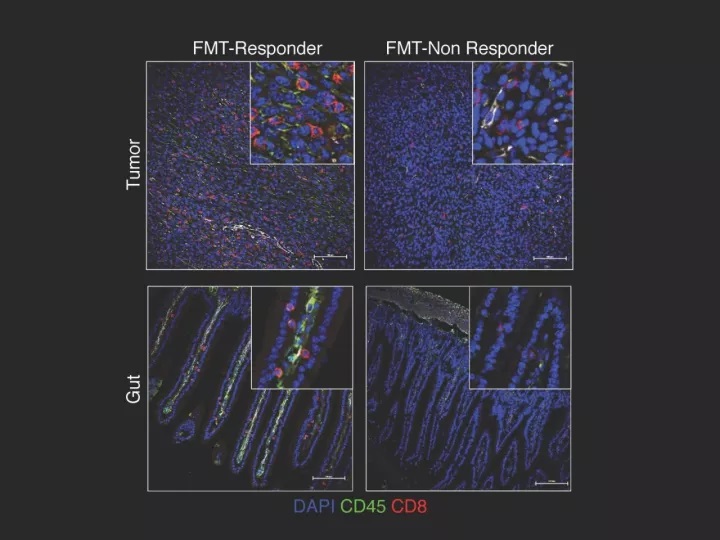
▲益生菌能增加肿瘤和肠道内有益T细胞的数量(图片来源:《科学》)
后续研究表明,益生菌较多的患者,T细胞能更好地穿透肿瘤进行杀伤。而带有“坏细菌”的患者则有更多的调节性T细胞,它们能抑制免疫反应(相关阅读:Nature子刊:意外!增强肿瘤免疫疗法,我们也许错了10年)。同样,接受了“起效者”粪便的小鼠,体内的免疫抑制性细胞更少,对免疫检查点抑制剂治疗的反响也越佳。
《科学》上今日的评论文章指出,这两项研究中发现的益生菌并不完全相同,这可能反映了不同地区具有不同饮食习惯的人群内,肠道菌群种类的差异。但总体来说,两项研究中找到的菌群仍然有不少重叠。这证实了肠道菌群对于人类抗癌免疫疗法的关键作用。
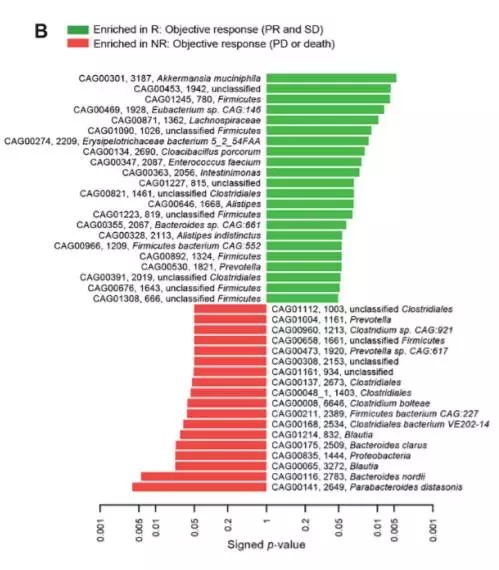
▲第一项研究中也发现,对免疫疗法有反应的患者(绿色),肠道菌群和对免疫疗法无反应的患者(红色)有明显不同(图片来源:《科学》)
这两项研究在临床上也有着极大的影响。现在,我们知道只要不服用抗生素,就有望把抗PD-1免疫疗法的效果从25%提高到40%!另外,通过粪便移植,我们有望让癌症患者更好地从免疫疗法中受益。
正如一些科学家所言,“这是目前规模最大,做得最好的评估,让我们能够了解微生物组如何影响免疫疗法的疗效”。我们体内的这些小生物,正在为医学带来革命性的变化!
参考资料:
[1] Your gut bacteria could determine how you respond to cutting-edge cancer drugs
[2] Gut microbiome influences efficacy of PD-1–based immunotherapy against epithelial tumors
[3] Gut microbiome modulates response to anti–PD-1 immunotherapy in melanoma patients
[4] Bacteria in the gut modulates response to immunotherapy in melanoma

















