
1#Cell:人工智能又厉害了!构建最大规模的“神经-行为”蓝图
Mapping the Neural Substrates of Behavior
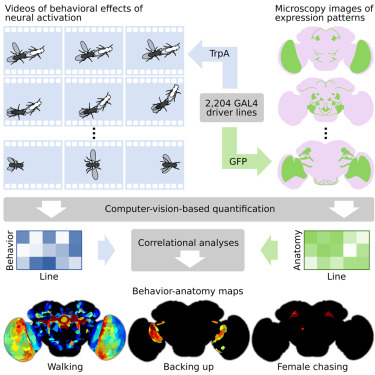
人类大脑有860亿个神经元,果蝇只有约10万个神经元,因此科学家们热衷于选择果蝇作为研究行为神经学的模式动物。然而,即便是果蝇,记录支配飞行、行走、求偶等行为的神经回路也是繁杂而沉重的任务。
2017年7月13日发表在Cell杂志上的这项研究中,来自霍华德休斯医学研究所的科学家们借助于人工智能(AI),投入40万只果蝇,分析1000亿个注解,耗时6年完成了一个史诗级别的项目——创建了成年果蝇整个大脑神经回路图谱,并将这些回路与特定的行为对应起来。
这一研究规模空前、处理数据量超乎想象。业内很多学者将这一图谱评价为“金矿”,认为它为后续研究提供了很好的基础。【详细】
2# Cell:别怪夜猫子自制力差,他们可能是基因突变了!
Mutation of the Human Circadian Clock Gene CRY1 in Familial Delayed Sleep Phase Disorder
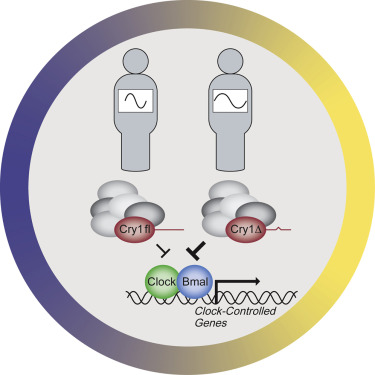
2017年4月6日发表在Cell杂志上的这项研究中,洛克菲勒大学的研究人员发现,基因CRY1的突变减慢了体内的生物钟。携带这种“夜猫子”突变的人比大多数人有更长的昼夜周期,这使得他们保持清醒的时间被推迟。
事实上,认为自己是夜猫子的人经常被诊断为睡眠相位后移综合症(DSPD)。这类人的24小时睡眠-觉醒周期(sleep-wake cycle)会被推迟,使他们在大多数人睡着很久以后还能保持精力充沛。
当对DSPD患者的DNA进行检测时,研究人员发现,名为CRY1的基因发生了突变。研究中,科学家们还分析了DSPD患者家庭中的其他成员,并发现有5名亲属也携带了CRY1基因的突变。
随后,他们又考察了来自世界各地的大型遗传数据库,以确定CRY1突变的流行程度。通过与土耳其研究人员合作,他们发现了几十名携带CRY1突变的土耳其人。
最后,在搜索了更大的遗传数据库后,研究小组估计,在非芬兰人的欧洲血统中(non-Finnish European descent)每75人就有1人(one in 75 people)携带至少一个拷贝的DSPD突变。特别值得一提的是,DSPD突变是显性的,这意味着只携带一个拷贝也可能会导致睡眠障碍。【详细】
3# Cell:让癌症免疫疗法更精准
Innate Immune Landscape in Early Lung Adenocarcinoma by Paired Single-Cell Analyses
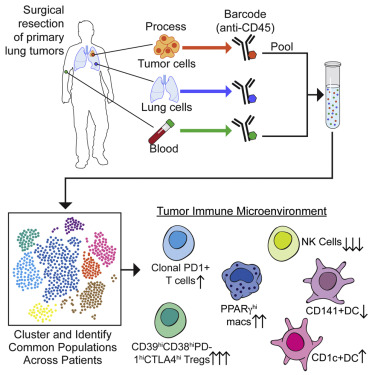
2017年5月4日,发表在Cell杂志上的两项独立研究描绘了围绕肿瘤的免疫细胞明细图(Detailed maps)。这些重要的发现有望帮助判断开始癌症治疗的最佳时间,进而开发出更精准的癌症免疫疗法。
在题为“Innate Immune Landscape in Early Lung Adenocarcinoma by Paired Single-Cell Analyses”的论文中,来自美国的一个科学家小组对肺癌进行了研究,结果发现,早期肿瘤也会扰乱免疫细胞的活性。
论文的通讯作者Miriam Merad说:“我们发现,免疫细胞在肿瘤形成非常早期时就开始功能失调了,但癌症免疫疗法通常在患者病情复发和癌症晚期时才被使用。我们希望倡导在癌症的更早阶段开始使用免疫治疗,以免为时过晚。”
具体来说,Merad的研究组调查了28名早期或晚期肺腺癌患者的肿瘤样本和正常组织。结果发现,1期肿瘤(Stage 1 tumors)已经显示出大量抑制性巨噬细胞和T细胞的聚集,以及NIK细胞的损耗。这些肿瘤通常是通过手术切除,虽然它们预后良好,但仍有25%的患者复发。
Merad说:“在这一研究中,我们鉴定出了很多免疫抑制变化。我们对这些结果感到非常兴奋,因为我们相信,与在肿瘤体积更大时释放免疫攻击相比,在肿瘤很小的阶段就靶向肿瘤细胞,清除所有肿瘤细胞的机会更大。”【详细】
4# Cell报道大麻素受体的结构生物学研究结果
Crystal Structure of the Human Cannabinoid Receptor CB1
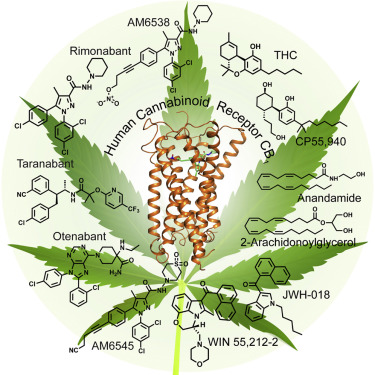
人源大麻素受体(human Cannabinoid Receptor 1, CB1)是人的中枢神经系统中表达量最高的G蛋白偶联受体(GPCR),也是治疗疼痛、炎症、肥胖症以及药物滥用的潜在靶点。然而,由于长期以来缺乏CB1的结构信息,基于CB1的药物研发并不顺利。
在这篇Cell论文中,包括中国科学家在内的国际研究小组解析了CB1-AM6538复合物2.8埃分辨率的晶体结构。该晶体结构揭示了CB1中拮抗剂小分子AM6538复杂的疏水结合口袋。AM6538非共价的紧密结合模式使其具备了成为长效缓释药物分子的巨大潜力,该特性也是治疗成瘾障碍药物的基本要求。此外,通过基于CB1的三维结构的分子对接及动力学模拟分析,研究人员还获得了不同类型的小分子激动剂与CB1的结合方式,揭示了配体小分子与CB1相互作用的一些新模式和新见解。
总结来说,该研究揭示出的CB1的三维精细结构对设计更加特异和副作用更小的拮抗剂类药物具有极大的推动作用。
5# Cell:干细胞里程碑!科学家首次培育出人猪嵌合体胚胎
Interspecies Chimerism with Mammalian Pluripotent Stem Cells
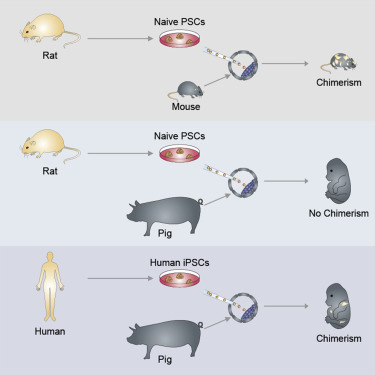
2017年1月26日,发表在Cell杂志上的这项研究中,来自Salk研究所的科学家小组借助“魔剪”CRISPR技术首次成功培育出了人-猪嵌合体胚胎。
培育嵌合体胚胎分为两个阶段。首先,利用CRISPR技术删除猪胚胎内形成器官的关键基因,创造遗传“空位”;其次,把人类诱导多能干细胞注入猪胚胎内。
具体来说,研究人员将人类诱导多能干细胞与猪的胚胎相结合,然后将这些嵌合体胚胎植入代孕母猪体内后,让这些胚胎发育仅3周或4周,以检查人类细胞是否发挥了作用。研究中,他们共将超过2000个人猪嵌合体胚胎植入到41只代孕母猪体内,一个月后,有186个胚胎存活。然而,许多胚胎远小于正常胚胎,似乎长得更慢。
值得一提的是,科学家们共使用了3种不同状态的诱导多能干细胞。结果显示,中间态多能干细胞(intermediate hPSC)最适合形成嵌合体。
该研究的通讯作者 Juan Carlos Izpisua Belmonte表示,这是干细胞研究领域的一个里程碑。该研究的最终目标是在动物体内培育出可供移植的人类细胞、组织和器官。【详细】
6# Cell:溶瘤病毒能让癌症免疫疗法更有效
Oncolytic Virotherapy Promotes Intratumoral T Cell Infiltration and Improves Anti-PD-1 Immunotherapy
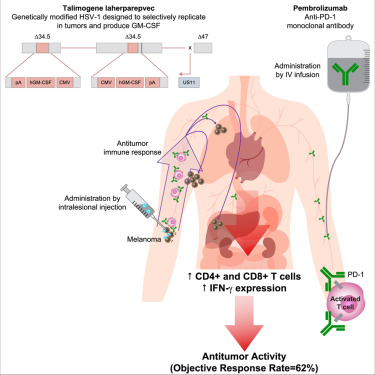
目前,如何扩大能够获益于癌症免疫疗法的患者群体是这一领域最热门的研究方向之一。免疫联合疗法被很多人认为是解决这一难题的最终手段。2017年9月7日,Cell杂志上发表的这篇论文带来了一个“好消息”。在一项涉及21名患者的1b期临床试验中,研究人员测试了PD-1抗体Keytruda与溶瘤病毒T-VEC联合疗法的安全性和有效性。结果表明,Keytruda+T-VEC联合治疗的缓解率(response rate)为62%,可能比单独使用其中任何一种疗法效果都好。
具体来说,试验中,患者肿瘤间隔3周被注射了两次T-VEC。从第6周开始,患者每两周接受Keytruda治疗,同时接受额外的T-VEC注射。结果显示,在第6周时(2次T-VEC治疗后,Keytruda治疗开始前),大多数肿瘤被浸润了T细胞。在第30周时,T细胞依然保留在这一区域,但大部分肿瘤细胞消失了。
参与这一1b期多中心试验的21名转移性黑色素瘤患者总缓解率为62%,这意味着他们的肿瘤缩小了。其中,三分之一患者为完全缓解,意味着他们的肿瘤已无法被检测到了。这一联合疗法的缓解率比单独使用Keytruda或T-VEC治疗的预期缓解率(通常约为35%-40%)要高得多。
让人欣喜的是,除了有效性的提升,Keytruda+T-VEC联合治疗的副作用也没有比单独使用其中一种药物带来的副作用更糟,包括疲劳寒颤(fatigue chills)和发烧。【详细】
7# Cell:对抗寨卡病毒感染的mRNA 疫苗
Modified mRNA Vaccines Protect against Zika Virus Infection
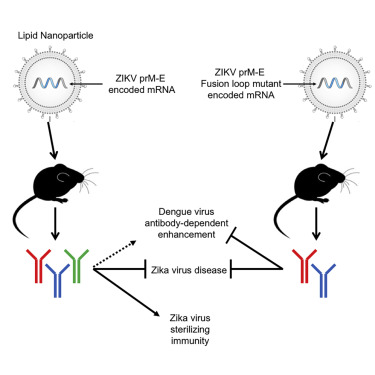
2017年3月9日,发表在Cell杂志上的这篇论文中,疫苗开发人员通过注射编码病毒蛋白质的合成信使RNA成功帮助小鼠抵抗了寨卡病毒。论文的共同通讯作者Giuseppe Ciaramella说:“寨卡病毒会将它们的RNA注入细胞质中,然后‘劫持’细胞的翻译机制来产生抗原。我们的mRNA疫苗能够让细胞做同样的事情。”
具体来说,这种疫苗包含了用于编码2种寨卡病毒蛋白质的RNA,当疫苗RNA进入小鼠细胞后,核糖体会利用它来构建对应的蛋白质。这两种蛋白质不能感染任何其它细胞,但它们足以让小鼠免疫系统学会识别寨卡病毒,建立免疫力。
事实上,由于寨卡病毒可以进入大脑,因此,研究人员一直在犹豫是否要使用减毒的寨卡病毒让机体产生免疫力。一些科学家担心,减毒的病毒可能仍会对大脑造成一些损伤。可喜的是,RNA疫苗可以解决这一担心,因为RNA不会到达大脑。
除了这一点,使用RNA疫苗的另一个关键优势在于它们的可变性。生物学家在改变RNA链方面已有很多经验,这使得定制RNA疫苗更加容易。
8# Cell:帕金森病竟然是肠道微生物作怪?
Gut Microbiota Regulate Motor Deficits and Neuroinflammation in a Model of Parkinson’s Disease
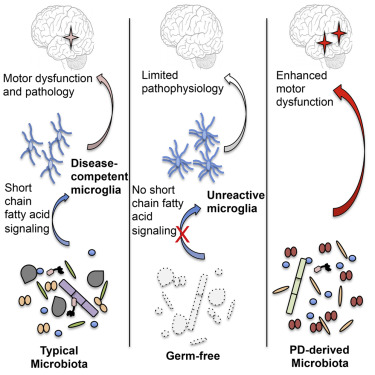
肠道菌群已经成为近年来最火爆的研究领域之一。在这篇论文中,来自加州理工学院的科学家们首次证实肠道细菌和帕金森病(PD)之间的功能联系。研究表明,肠道菌群的组成变化,或是肠道细菌本身的改变,都可能对帕金森病中运动能力的恶化产生极大影响。
作为第二常见的神经退行性疾病,PD在全世界范围内影响着1000万人,其症状主要包括震颤、步行困难、大脑黑质中多巴胺能神经元的缺失、大脑和肠内的细胞出现α-突触核蛋白(α-Syn)的聚集、脑内出现炎症分子等等。此外,75%的PD患者都出现了胃肠道功能异常,其中最主要是便秘。
由于胃肠道问题通常在运动症状出现之前就已经发生了,因此,研究人员推断肠道微生物可能是导致PD的罪魁祸首之一。
为了证实这一猜想,研究人员使用了过表达α-Syn并表现出帕金森症状的小鼠。其中,一组小鼠具有复杂的肠道菌群;另一组则为无菌小鼠(在完全无菌的环境中繁殖,因此缺乏肠道细菌)。通过测试两组小鼠的运动技能,研究人员发现,无菌小鼠的表现明显优于具有完整微生物组的小鼠;同时,帕金森病的典型症状在无菌小鼠中都消失了。基于这些结果,科学家们确定,肠道菌群在帕金森病症状中扮演着重要角色。【详细】
9# Cell证明“辟谷”能治糖尿病
Fasting-Mimicking Diet Promotes Ngn3-Driven b-Cell Regeneration to Reverse Diabetes
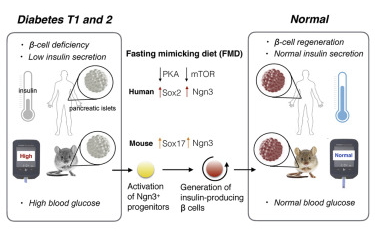
“辟谷”源自道家养生中的“不食五谷”,是古人常用的一种养生方式。很多人认为“辟谷”仅仅是古人对“不食五谷,吸风饮露”的仙人行径的想象与向往,但现今越来越多的研究却为“辟谷”找到了有益健康的科学依据。2017年2月23日,Cell杂志报道的一篇来自美国南加州大学的研究表明,模仿空腹效果的节食方式能促进生产胰岛素的胰腺细胞的再生,在小鼠中减轻1型和2型糖尿病的症状。
具体来说,该研究证实,每周四天空腹禁食的小鼠在糖尿病方面有显著的扭转(即使在疾病晚期的小鼠中也是如此),它们恢复了健康的胰岛素生产,降低了胰岛素抵抗,并表现出了更稳定的血糖水平。
机制探索表明,模拟空腹的饮食策略在成年小鼠中开启了通常只在胚胎小鼠胰腺发育时活跃的基因。这些基因促进一个被称为neurogenin-3的蛋白质的生产,最终产生了新的、健康的、能生产胰岛素的β细胞。【详细】
10# Cell:DNA损伤期间,基因转录会发生什么变化?
UV Irradiation Induces a Non-coding RNA that Functionally Opposes the Protein Encoded by the Same Gene
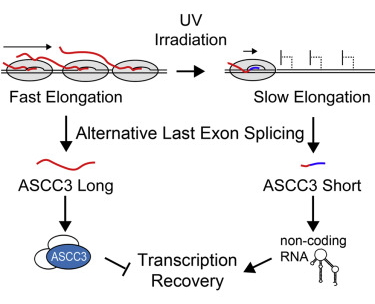
当DNA受到损伤时,细胞会激活相关的基因来修复损伤,并减缓很多其他基因的转录。2016年,英国Francis Crick研究所的Jesper Svejstrup及其同事们鉴定出了紫外线诱导DNA损伤后(after UV-induced DNA damage)与转录相关变化有关的一些因素(factors associated with tranion-related changes),包括ASCC3(该基因编码了参与调控基因表达的蛋白)的转录。
在2017年2月23日发表于Cell杂志上的这篇论文中,Svejstrup等发现,正常情况下较长的ASCC3转录物(trans)会在DNA受到损伤后变得更短。而敲除短的ASCC3转录物(在紫外线照射后产生的)会阻止细胞恢复正常的转录水平。“如果没有短的ASCC3转录物,细胞就不再能对DNA损伤做出正确的反应,并且会死亡。”Svejstrup解释道。
不过,对于短版的ASCC3转录物是如何帮助修复损伤的,科学家们还未找到答案。
参考资料:
Best of Cell 2017
Study identifies 'night owl' gene variant
刘志杰课题组在《Cell》报道大麻素受体的结构生物学研究结果
More evidence that Zika mRNA vaccines can stop viral replication in mice
What happens to gene tranion during DNA damage?
Noncoding RNA Helps Cells Recover from DNA Damage
Cell全新发布:2017年度最佳综述TOP4出炉!
Cell:癌症转移的生物学原理
Emerging Biological Principles of Metastasis
人类癌症的多样性超过200种不同的疾病。尽管科学家们在癌症研究、诊断和治疗方面已经取得了重大的进展,但绝大多数晚期转移性疾病患者利用目前的治疗方案是无法被治愈的。约90%与癌症相关的死亡是由转移性癌症而不是原发性肿瘤导致的。
癌细胞从原发性肿瘤中“出走”并“定居”到远处组织中新的肿瘤位置涉及了多个步骤,整个过程被称为侵袭-转移级联(invasion-metastasis cascade)。这一系列事件包括原发性肿瘤细胞向周围组织局部侵袭(local invasion)、这些癌细胞渗入循环系统并在血性运输(hematogenous transit)中存活、通过血管壁进入远处组织的实质(parenchyma)、在这一实质部位形成微转移集群(micrometastatic colonies)以及最后一步“定居”(colonization),即微转移集群增殖形成明显的、临床上可检测的转移性病灶。
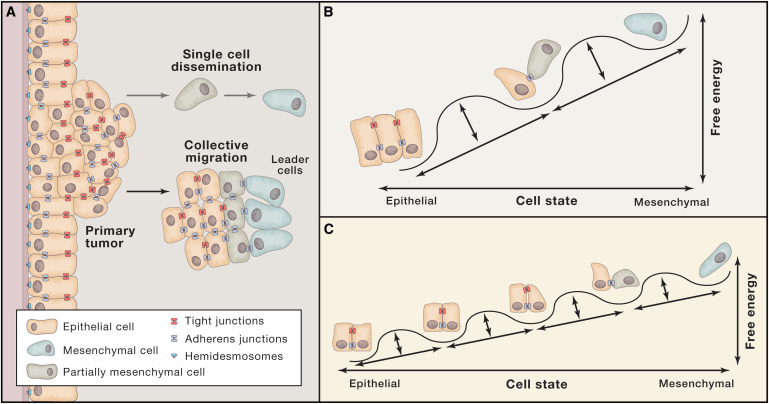
Dissemination of Carcinoma Cells.(A)Carcinoma cell dissemination occurs via two mechanisms:single-cell dissemination through an EMT(gray arrow)or the collective dissemination of tumor clusters(black arrow). Recent evidence suggests that the leader cells of tumor clusters also undergo certain phenotypic changes associated with the EMT.(图片来源:Cell)
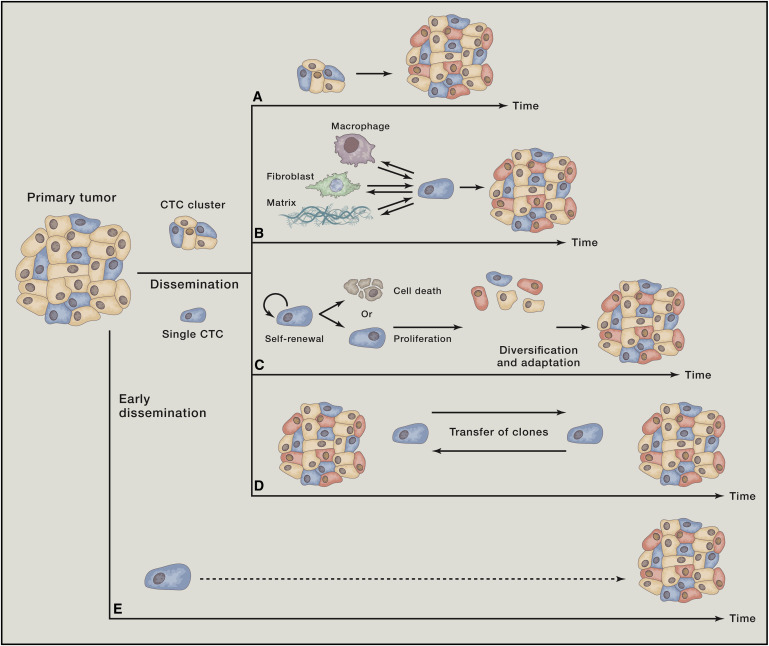
Dynamics of Metastatic Evolution(图片来源:Cell)
尽管已有大量的研究揭示出了导致原发性肿瘤形成的详细病理机制,但与癌症转移相关的生物学基础目前仍然知之甚少。不过,已经出现的一些成果将帮助我们理解不同类型的转移是如何产生的,以及它们与相应原发性肿瘤的行为有多相似或不同。
在这篇2017年2月9日发表的题为“Emerging Biological Principles of Metastasis”的论文中,Whitehead生物医学研究所的3位科学家总结了揭示癌细胞扩散和转移背后机制(包括细胞机制和分子机制)的一些重要进展,并指出了已经出现的、有关转移的共同生物学原理(common biological principles)。
作者们强调,转移是导致癌症相关死亡的主要原因,然而这个复杂的过程仍然是癌症生物学中最少被理解的方面。更好的了解原发性肿瘤及其转移性“后代”(即转移性肿瘤)之间的生物学异同(尤其是在异质性、可塑性和耐药性方面)是非常迫切的事情。他们认为,这对开发专门用于预防或治疗转移性癌症的新途径和疗法是至关重要的。
Cell:生长、代谢和疾病中的mTOR信号
mTOR Signaling in Growth, Metabolism, and Disease
1964年,前往复活节岛的一个加拿大探险队收集了一套土壤样本,目的是为了鉴定新型的抗菌剂。在从其中一个样本中分离出的细菌中,Sehgal及其同事发现了一种具有显著抗真菌、免疫抑制和抗肿瘤特性的化合物——雷帕霉素(rapamycin)。对该化合物的进一步分析显示,它之所以能发挥这些作用,部分是通过与肽基脯氨酰异构酶(peptidyl-prolylisomerase)FKBP12形成了一种功能复合体,从而抑制了细胞生长和增殖所需的信号转导途径。
1994年,一些生物化学研究发现,在哺乳动物中,rapamycin-FKBP12复合体的直接靶点是mTOR(mechanistic target of rapamycin),且mTOR是酵母TOR/DRR基因的同源基因。之后的20多年里,来自全球几十个实验室的大量研究表明,mTOR蛋白激酶是一种主要的真核信号网络,它能够协调细胞生长与环境条件,在细胞和有机体的生理机能方面起着基础性作用。mTOR信号异常与癌症、糖尿病的进展以及衰老过程有关。
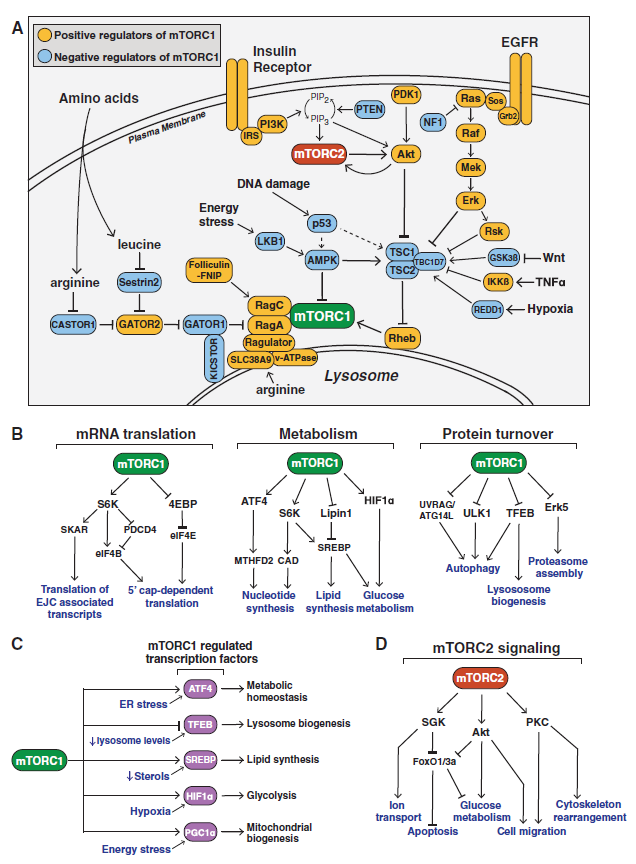
The mTOR Signaling Network(图片来源:Cell)
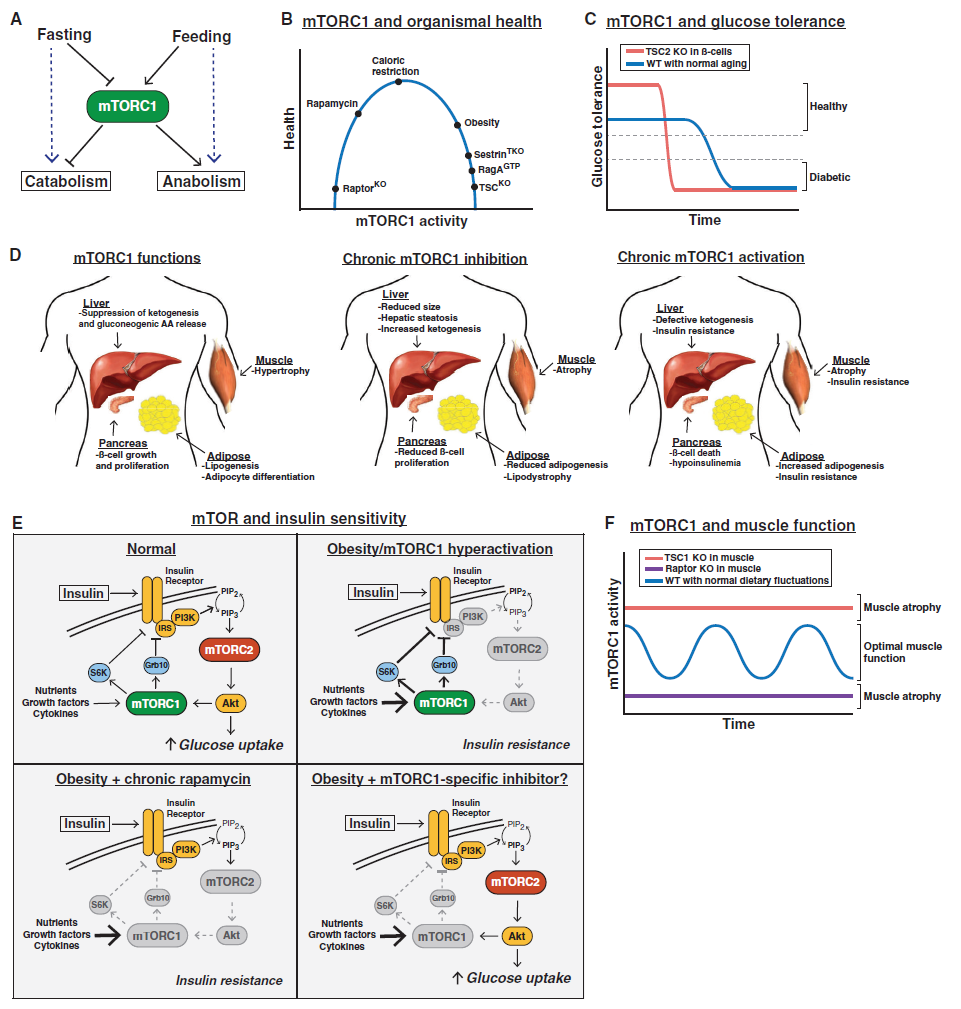
Physiological Roles of mTOR(图片来源:Cell,点击图片查看大图)
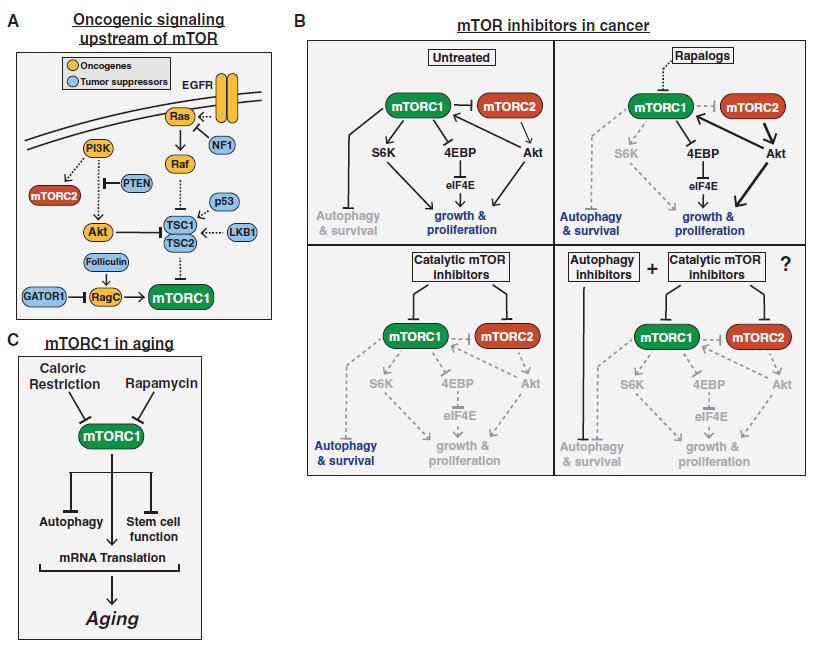
mTOR in Cancer and Aging(图片来源:Cell)
在2017年3月9日发表的题为“mTOR Signaling in Growth, Metabolism, and Disease”的这篇综述中,来自Whitehead生物医学研究所的2位科学家总结了一些帮助我们理解mTOR功能、调节和重要性(主要是在哺乳动物生理学中)的近期研究进展,分析了mTOR信号网络是如何导致人类疾病的,并讨论了临床中靶向mTOR的疗法的当前和未来前景。
Cell:免疫力的“代谢指令”
Metabolic Instruction of Immunity
免疫系统的细胞拥有特定的技能,这些技能对宿主防御和组织内稳态至关重要,但如果不加以适当控制,也会导致疾病。与体内的其他细胞不同,免疫细胞具有对环境信号做出反应的能力,并具有各种不同的功能。免疫细胞可以从休眠的“哨兵”变为致病菌杀灭“机器”,可以从一个组织迁移到另一个组织,可以调节表面受体的表达,可以分泌大量的效应分子,或对相邻细胞施加控制作用。在一次免疫反应(活性爆发)之后,这些特殊的细胞可能会死亡(在特定的环境中创造空间并限制组织损伤),也可能会回到“休眠状态”(该状态下,免疫细胞能够在较长时间内持续存在,以便进行二次免疫反应)。
免疫细胞的活化、生长和增殖、效应功能以及内稳态都是密切相关的,且依赖于细胞代谢的动态变化。而特定代谢途径的利用在一个层面上受生长因子和营养可用性的控制,在另一个层面上受内部代谢物、活性氧、还原和氧化底物的精细平衡的控制。
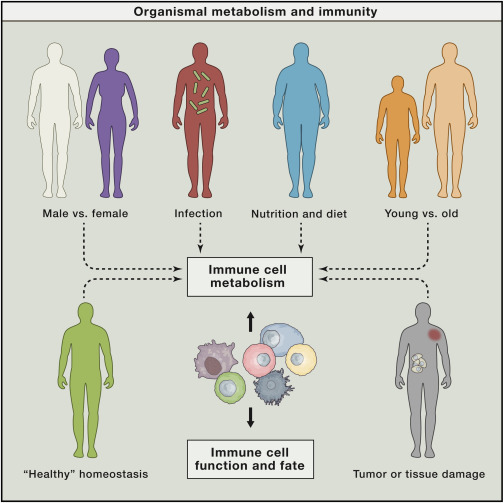
Tying Organismal Metabolism to Cellular Metabolism and Immunity(图片来源:Cell)
在2017年5月4日发表的这篇题为“Metabolic Instruction of Immunity”的综述中,来自Max Planck免疫生物学和表观遗传学研究所以及耶鲁大学医学院的科学家们探讨了免疫细胞及其所居住的组织环境之间的相关作用以及这些作用是如何影响免疫细胞代谢的、代谢又是如何指导免疫细胞的功能和命运的、这些关系又是如何形成组织内稳态和疾病病理学的。作者们认为,利用免疫细胞独特的代谢有望产生新的治疗靶点。
Cell:聚焦p53
Putting p53 in Context
p53是在肿瘤病毒研究的高峰时期被发现的一种53 kD的宿主蛋白。最初,科学家们将p53归类为致癌基因,随后的研究证实,由TP53编码的野生型p53能够在细胞培养中抑制生长和致癌性转化,并且在人类肿瘤中失活的TP53突变是很常见的。不过,2010年的一项研究称,在许多癌症中,P53突变与患者预后不良有关。
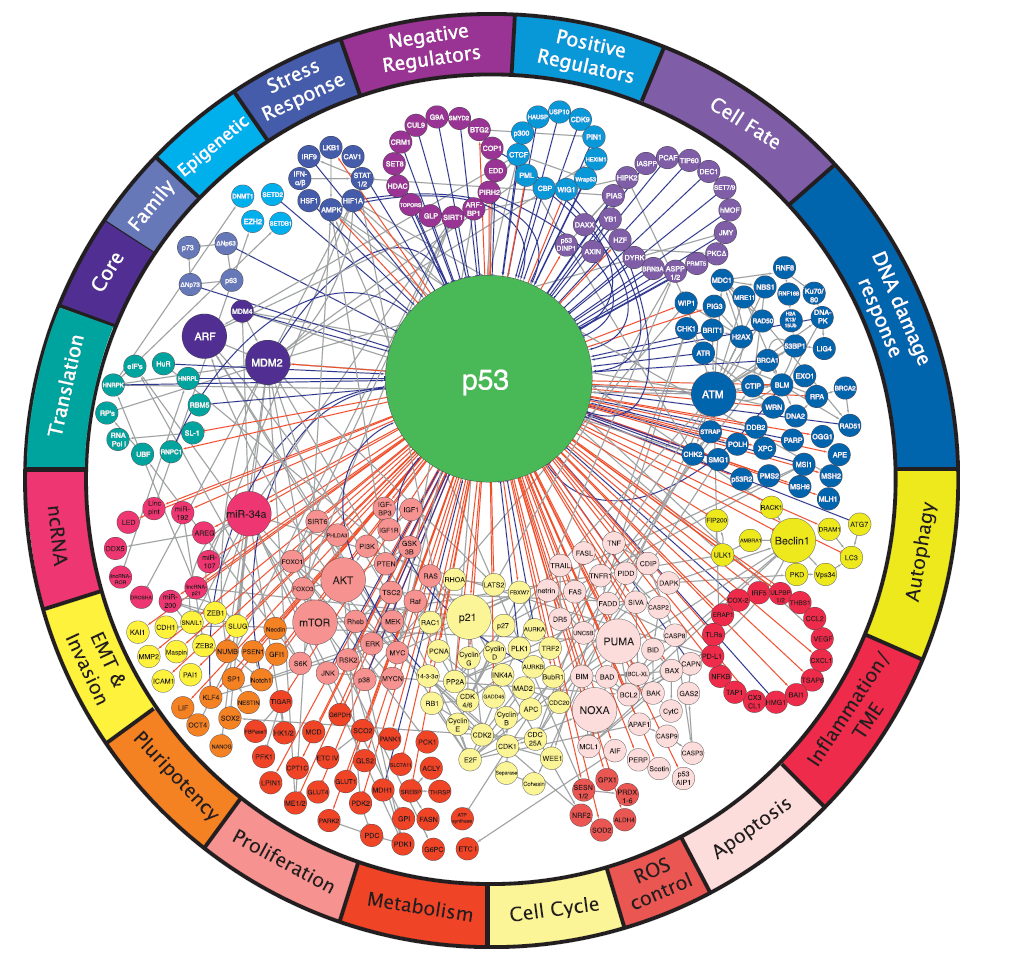
The p53 Network(图片来源:Cell,点击图片查看大图)
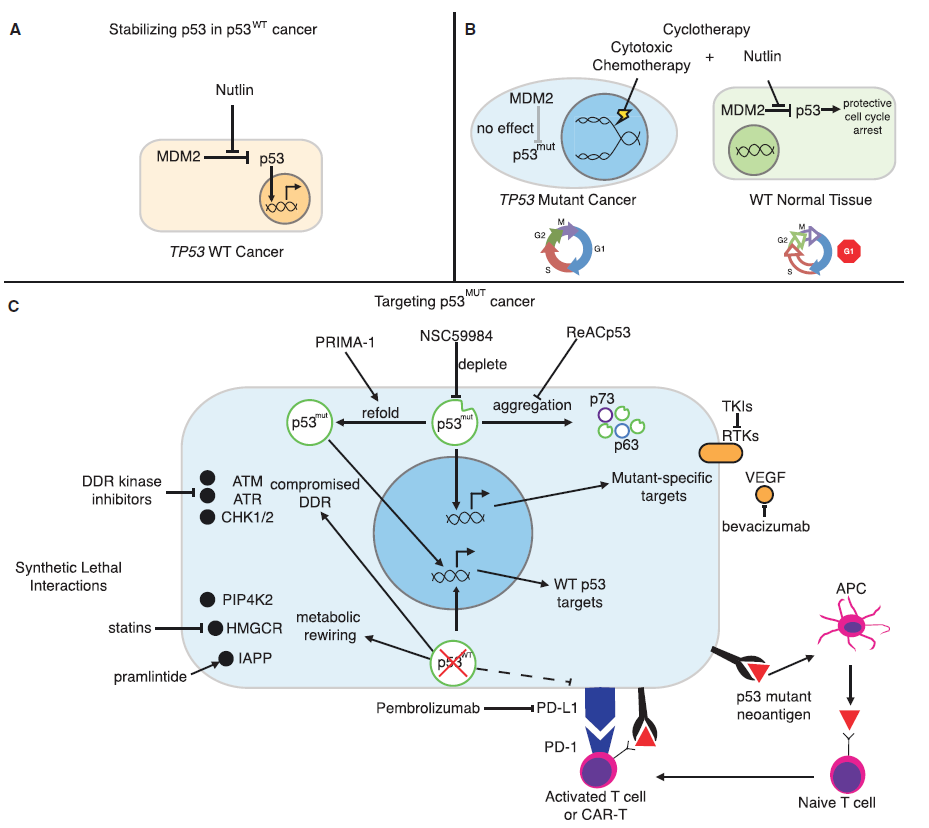
Harnessing p53(图片来源:Cell)
2017年9月7日,来自Memorial Sloan Kettering癌症中心的两位科学家在Cell杂志上发表了题为“Putting p53 in Context”的综述。作者们指出,TP53是人类癌症中最常见的突变基因。从功能上来说,p53是由一系列应激刺激(stress stimuli)激活的,进而控制着一种异常复杂的抗增殖转录程序(anti-proliferative transcriptional program)。尽管p53网络的许多方面都被揭开了,但对于p53如何以及在何种背景下发挥其不同作用的清晰认识目前尚不清楚。该综述讨论了如何解释p53的不同活性及其功能障碍的后果,以及如何在癌症中修复它的肿瘤抑制活性。
参考资料:
Best of Cell 2017

















