引言
《孙子兵法》有云:“知己知彼,百战不殆;不知彼而知己,一胜一负;不知彼,不知己,每战必殆”。如果把肿瘤的免疫治疗比作是一场战争,癌细胞与免疫系统就是敌我双方,那如何做到知已知彼呢? 《权利的游戏》中情报之王瓦里斯有一句名言:” information is power”,在战争之中,情报就是力量,情报越准确及时全面,就越能够占据战争的主动权,也就越可能贏得战争。肿瘤的免疫治疗何尝不是如此,要做到知已知彼,就需要通过各类标志物了解肿瘤和自身免疫系统的状态,以分析出最佳的治疗策略。
然而,如今肿瘤治疗的标志物纷杂众多,有PD-L1表达,微卫星不稳定性(MSI),肿瘤突变负荷TMB, 错配修复缺陷(dMMR),以及肿瘤浸润淋巴细胞(TIL)等等。标志物之多,让很多专家面临选择困难症。回想起靶向时代多么的美好,一种药物通常也就对应着少许几个基因的突变(多靶点药物除外)。而今免疫治疗这么多的标志物与疗效研究,让人深感雾里看花,水中望月。所以笔者才决计写一篇长文,盘点一下免疫治疗时代的标志物大全。而且本文除了盘点免疫治疗的疗效预测标志物之外,还将讨论一下与免疫治疗耐药、疗效评估和监测等方面相关的标志物。
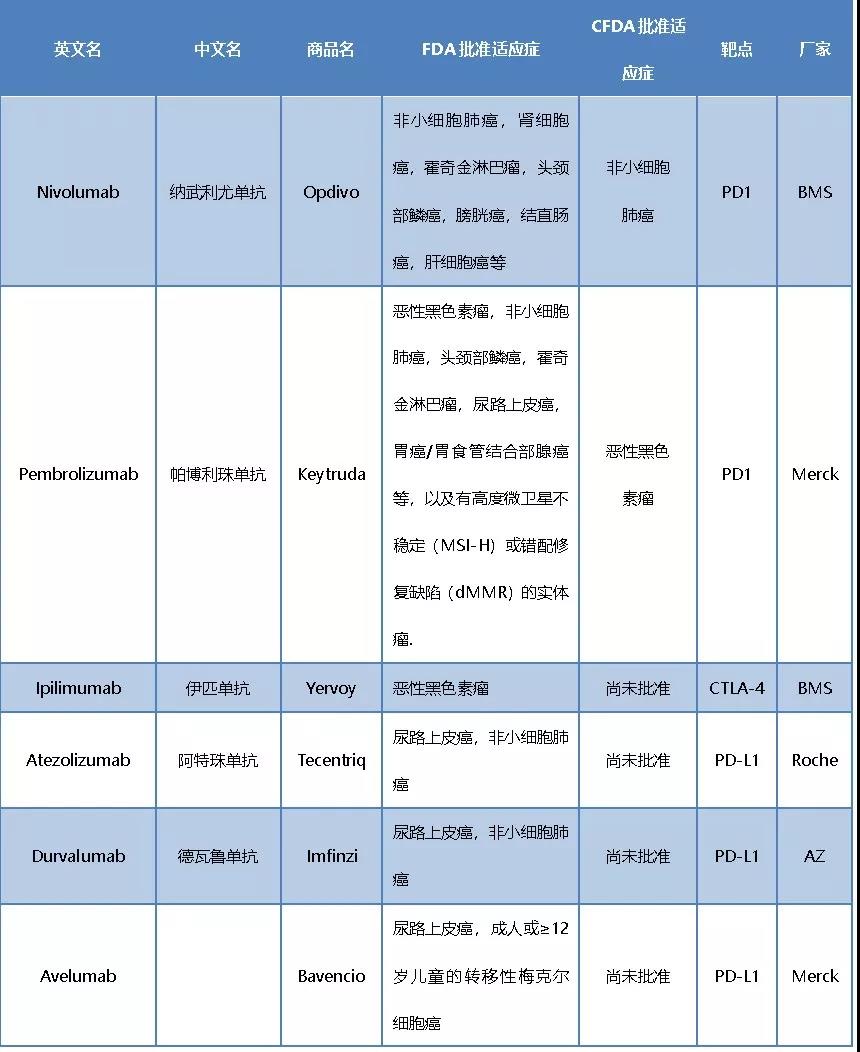
肿瘤的免疫治疗是一个很广的概念,包括单克隆抗体类免疫检查点抑制剂、治疗性抗体、癌症疫苗、细胞治疗甚至溶瘤病毒等都可以和免疫治疗挂上钩。本文只专注于近期火热的PD-1/PD-L1,以及CTLA-4单克隆抗体类免疫检查点抑制剂的分子标志物。这一类药物中的明星代表Opdivo(Nivolumab, 纳武利尤单抗)和Keytruda(Pembrolizumab, 帕博利珠单抗),也就是常说的O药和K药已经连续被CFDA批准用于相应的适应征,都属于PD-1抑制剂。已被FDA批准,但尚未被中国CFDA批准的Tecentriq(Atezolizumab, 阿特珠单抗)、Bavencio(Avelumab)和Imfinzi(Durvalumab)属于PD-L1抑制剂。PD-1抑制剂和PD-L1抑制剂有什么区别呢?原来PD-1不但有配体PD-L1,还有另一个配体PD-L2。抑制了PD-L1只是抑制了PD-1/PD-L1结合这一条信号通路,而抑制PD-1则同时抑制了PD-1/PD-L2这条信号通路。当然,能不能说抑制PD-1就能比抑制PD-L1效果更强呢?目前还没有太多这样的证据,值得进一步探讨。
除了PD-1通路外,还存在着另一条CTLA-4也是属于免疫检查点信号通路,而上市较早的Yervoy(ipilimumab,伊匹单抗)则属于CTLA-4的抑制剂。
目前已有多个免疫点检查抑制剂药物获批,而且国内外也有很多药厂的药物在临床试验中。为了方便大家阅读比较,笔者将已获FDA/CFDA批准的该类型单抗进行了初步整理,列表如下:
在开始正式盘点相关的标志物之前,我们有必要了解一下免疫检查点抑制剂的工作原理。

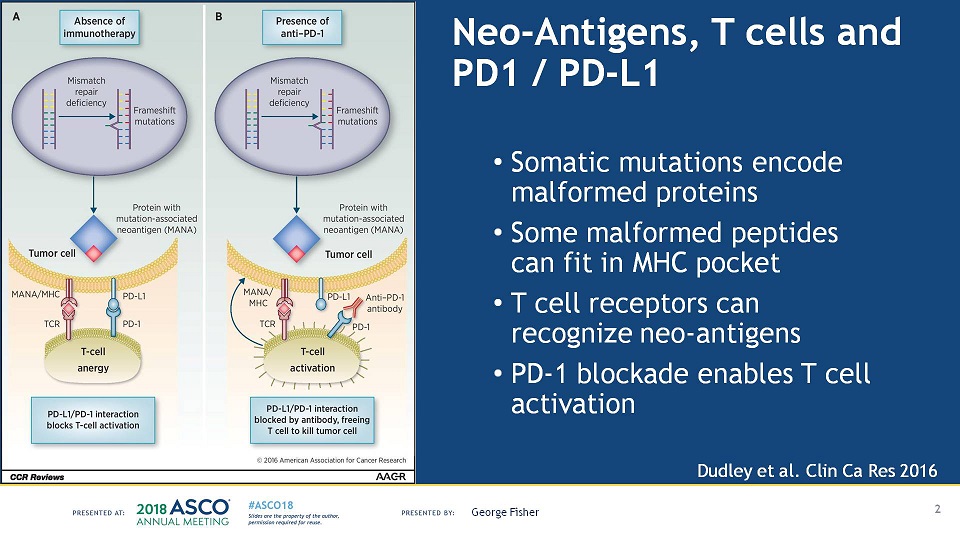
我们以今年ASCO会议上George Fisher博士描述的PD-1/PD-L1信号通路的一张幻灯为例。从图中我们可以看到,肿瘤细胞中的基因组发生了突变,如果这个突变刚好是在编码区,它就可能会改变蛋白氨基酸序列,形成新的抗原。然后如果运气比较好,这个新的抗原跟人的MHC(主要组织相容性复合体, major histocompatibility complex)可以很好地嵌合,MHC就会把它呈递到细胞的表面,便于T细胞来识别。这个时候,如果T细胞的功能是激活状态的,就会激活免疫反应,免疫系统就可能会把这个变异的肿瘤细胞杀死。
但是,肿瘤细胞也很聪明,它知道,只要自己表达出PD-1的配体PD-L1,让它跟T细胞的PD-1结合,就可以抑制免疫应答,这样即便是MHC把新生抗原呈递到了细胞表面,T细胞也会无动于衷。这个PD-L1和PD-1握手的过程就像是两家联姻,联姻之后就是亲家了,自家人当然不打自家人。
那怎么办呢,聪明的科学家们想到了两种办法。第一种是使用外源性的PD-1单抗,竞争性地跟T细胞的PD-1进行结合,这样肿瘤细胞就会没机会和T细胞结婚了,当然也就不是自家人了。第二种则是使用外源性的PD-L1单抗,竞争性地跟肿瘤细胞的PD-L1进行结合,这样也同样地阻断了PD-1和PD-L1的握手联姻。这就是为什么会有PD-1单抗,也有PD-L1单抗的原因。
在分析完了免疫检查点抑制剂的原理之后,我们就可以开始盘点一下,影响这类治疗相关的因素可能有哪些。
1.首先,第一个关键的环节是必须要有突变,而且突变的数量和质量都很重要。所以与肿瘤突变数量直接相关的肿瘤突变负荷(TMB)会是一个重要的标志物。而如果进一步对突变进行区分,考虑一个突变是不是能够产生足够合适的新抗原,则可以导出另一个近期开始获得关注的标志物,即肿瘤新抗原负荷(Tumor Neo-antigen Burden, TNB)
2. 为了跟肿瘤细胞中产生的新抗原更好地绑定,需要有足够丰富多样的MHC系统。对于人类来说,也即需要有足够好的HLA (human leucocyte antigen,人类白细胞抗原, HLA)多样性。所以HLA的多样性可以是一个标志物之一。
3. 要让PD-1/PD-L1单抗药物起效,肿瘤细胞的PD-L1表达量也是另一个关键,所以PD-L1表达可以是标志物之一。
4. 肿瘤的微环境对于PD-1/PD-L1抑制剂能否起作用非常重要。例如,需要有足够的淋巴细胞浸润在肿瘤组织中,才能够在阻断PD-1/PD-L1结合之后,让T细胞发现并激发免疫反应。所以肿瘤浸润淋巴细胞(TIL)的丰度也可以是标志物之一。
5. 在细胞分裂的时候,有一定的概率会发DNA复制的错误从而产生突变。癌细胞分裂更快,也更容易产生这样的突变。人的基因组里面有一些基因是负责修复DNA的错配的,称为MMR(Mismatch Repair)基因,例如MLH1, MSH2, PMS2基因。如果MMR基因有缺陷,比如发生了启动子区间的超甲基化,或者移码突变而导致的蛋白功能失活,则称为dMMR(deficient Mismatch Repair),反之,则称为pMMR(proficient Mismatch Repair). 因为错配修复功能的缺陷而无法修复一些突变,具有dMMR的肿瘤患者可能会比pMMR的肿瘤患者具有更多的突变,所以dMMR也是一个相关标志物。
6. MMR基因的点突变是可以通过常规的NGS测序分析出来的,但是还有一些其他的变化,比如启动子的超基化对于常规的NGS建库测序方法却没办法直接测得。但是好在有另外一个指征可以侧面反应MMR系统是否工作良好,那就是微卫星不稳定性(MSI)。如果MMR系统出问题,微卫星复制的时候的错误可能会被保留,从而产生高微卫星不稳定性(MSI-H)。所以我们可以通过MSI的高低来侧面反应MMR系统的问题。MSI的高低可以通过PCR,或者NGS方法直接测得,也可以通过免疫组化方法侧面测得(主要通过测dMMR,因为dMMR的大多数会发生MSI),它可以作为一个重要的相关标志物。
接下来,我们就来盘点一下这些与免疫检查点抑制剂相关的标志物。
dMMR和MSI
具有dMMR或者高度微卫星高不稳定(MSI-H)的患者更能够从免疫治疗中获益。FDA已经批准帕博利珠单抗用于MSI-H/dMMR实体瘤患者。这是FDA首次批准不以肿瘤部位为参考,仅依靠生物标志物进行治疗选择。

从George Fisher博士的幻灯中,我们可以继续看出,MSI主要是由于dMMR引起的。更细地分析,它主要可能是因为遗传性突变(林奇综合症),表观沉默(如MLH1基因启动子的超甲基化),以及一些零散的突变引起的(如MLH1, MSH2, MSH6, PMS2基因等)。而检测dMMR的方法则主要有PCR方法、免疫组化方法、以及使用测序的方法检测MMR基因或者MSI的状态。
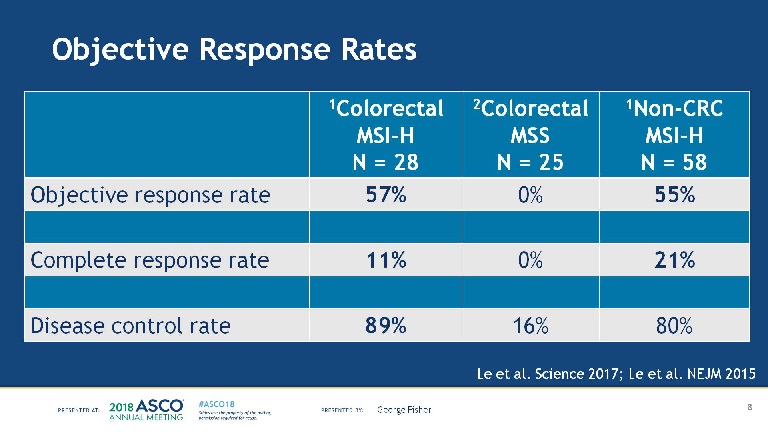
在Checkmate-016的试验中,MSI-H的结直肠癌和非结直肠癌组都达到了很高的客观响应率(57%和55%),而MSI稳定(即MSS)组的客观响应率则是的0%。
 PD-L1表达
PD-L1表达
对于PD-1/PD-L1抑制剂,使用免疫组化方法对PD-L1的表达定量作为标志物之一是顺其自然的事情。但是PD-L1表达定量也有几个缺陷:一是抗体众多,不同抗体之间比较难取得高一致性,而且不同的抗体对表达量计算的算法还不同;二是该方法需要专业的病理科医生对免疫组化的结果进行判别,这对于标志物水平的客观量化难免产生一定的影响,毕竟再专业的医生也难免产生一些主观差异。
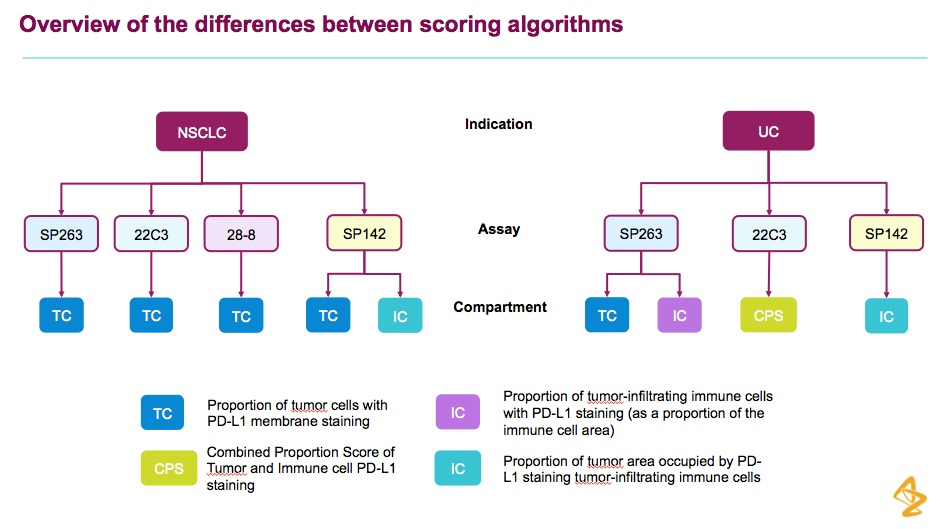
这张图片来自于AZ关于PD-L1免疫组化抗体和算法使用的盘点,可以看到,光是这里罗列的抗体就有4种。那究竟哪个抗体的效果最好呢?我们来看一看2018年北欧免疫组化质控中心的报告。
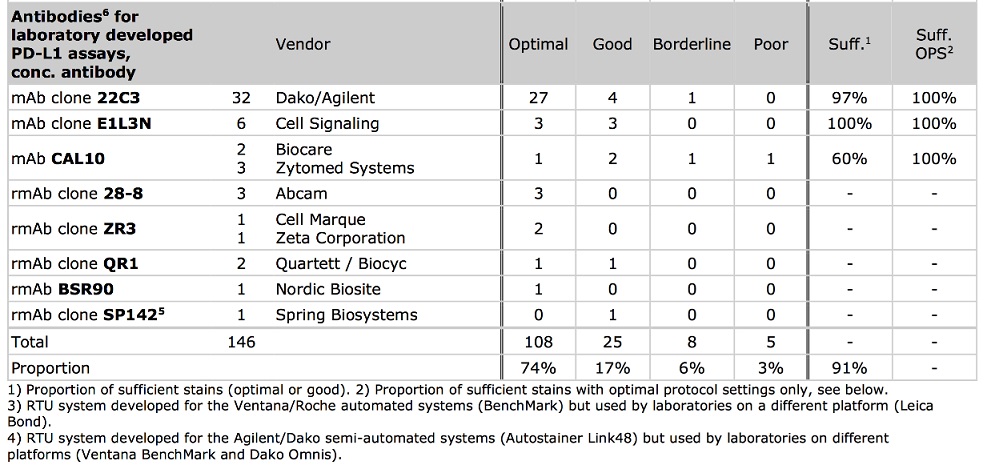
可以看到,其中22C3是最主流的抗体,表现也较为良好。而一些其它抗体,比如E1L3N,从成绩上看表现甚至优于22C3,但是因为样本数较少,统计显著性弱一些。
首先,要说明的是,肿瘤浸润淋巴细胞(Tumor infiltrating lymphocytes)本身也可以作为一种免疫疗法。手术切除的肿瘤组织,大部分是肿瘤细胞,也有少部分淋巴细胞。科学家可以通过一些培养方法把这些肿瘤组织中的淋巴细胞扩增起来。简单说就是从手术切除的肿瘤组织中分离扩增TIL细胞,扩增出来的细胞主要是CD4+和CD8+ T细胞,然后体外培养一段时间得到足够多的TIL细胞,回输到患者体内发挥抗癌作用。
因为PD-1/PD-L1抑制剂发挥作用,也需要肿瘤附近淋巴细胞的参与,所以TIL的丰度也可以作为预测PD-1/PD-L1抑制剂疗效的标志物,这通常是使用免疫组化评估肿瘤组织CD8+T细胞的浸润情况来实现的。而CD28,作为一种共刺激因子信号,也得到了关注。TIL细胞中CD28+的比例越高,通常也预示着治疗得到响应的可能性越大,这也可以通过免疫组化来进行检测。
在7月份一篇《Nature》的重磅论文中,癌症研究大牛Rosenberg博士发现,在CD8+的TIL中,只有一小部分对肿瘤的抗原敏感,而其它都是吃瓜群众。继续深入地研究发现,CD39的表达差异是区分CD8+ TIL是否对肿瘤敏感的关键因子。CD39是一种与慢性免疫细胞刺激有关的分子,通常在多种恶性实体瘤中明显上调。CD8+CD39+的TIL与慢性抗原持续刺激特征符合,表明这类TIL的活性被抑制住了,但是其抗肿瘤能力依然存在,只是需要有外来力量来解除其抗肿瘤能力的抑制,而PD-1/PD-L1抑制剂刚好就可以解除该类抑制。所以CD8+ TIL中CD39+的比例越高,就越可能让PD-1/PD-L1发挥作用。所以CD39+也是一个非常具有潜力的标志物。
行文过半,终于谈到我们的明星标志物TMB。为什么说它是明星标志物呢,因为在近几年不断有研究报道TMB与PD-1/PD-L1抑制剂的疗效高度相关性,而以TMB为标志物的临床研究大多数都顺利达到终点,几乎没有失败过。让我们用ASCO上的一张PPT,盘点一下TMB的历史吧。
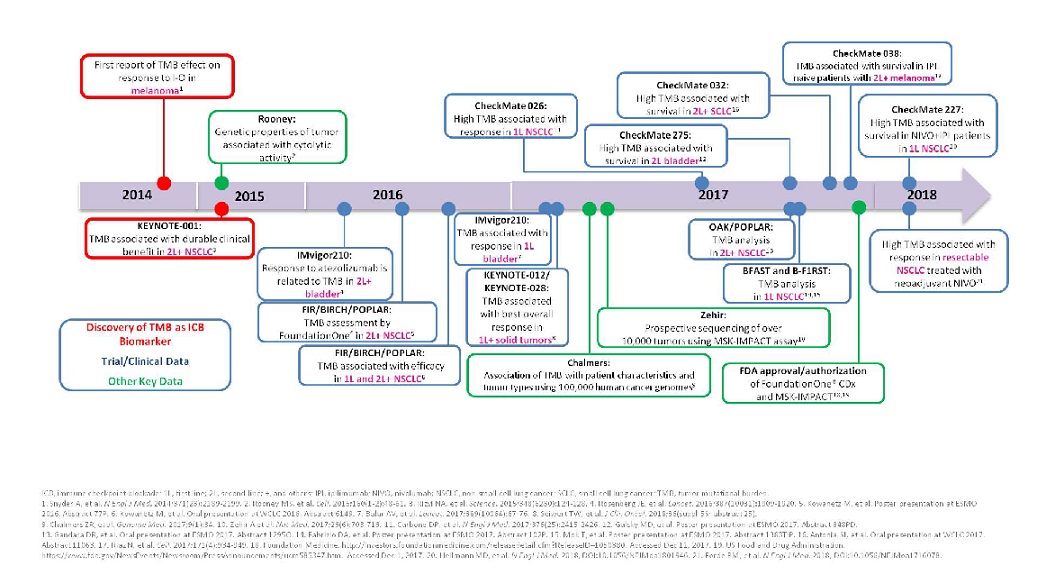
TMB与肿瘤免疫治疗的关联性报道已经有多年了,而且有非常多重要的里程碑,这一张图可以给出一个盘点。2014年,首次报道,黑色素瘤中,TMB高的患者对免疫治疗有高响应率,然后是KEYNOTE-001,在2线+的非小细胞肺癌中,TMB高低与可持续性受益显著相关。然后是CHECKMATE-026,开启NSCLC一线进行免疫治疗的大幕,最后不得不提今年的CHECKMATE-227,免疫治疗药物联用的结果呈绝对优势。
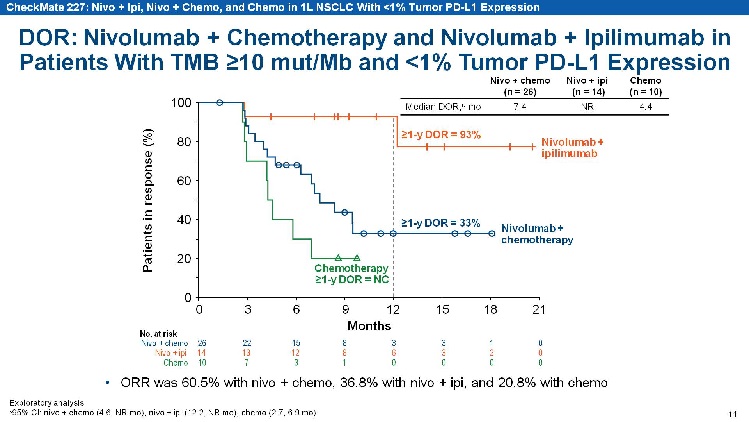
Checkmate-227的结果,相信很多人都已经见过多次,我这里还是展示一下。纳武单抗+化疗 vs. 纳武单抗+伊匹单抗 vs. 化疗的对比,其结果当然是双免疫治疗药物的效果大幅领先,一个阻断PD-1,一个阻断CTAL-4,不牛也不行。重点是,这是PD-L1表达量小于1%的结果,而只考虑了TMB大于等于10这一个标志物。这一战,也奠定了TMB作为肿瘤免疫治疗标志物一哥的地位,可以被认为是预测免疫治疗效果的独立因子。
TMB的定义通常是基因组中每1Mb蛋白编码区的平均突变个数,所以理论上最好的方案是对肿瘤进行全外显子测序(WES),这样就可以计算准确的TMB。但是,肿瘤的测序是需要有一定的深度要求的,而高深度的WES成本是非常高的,所以现在很多TMB的计算都是通过一个较大的Panel来进行拟合的。也正是因为如此,导致出现了不同的TMB计算方法,让很多人觉得很迷惑。
具体来说,在使用Panel进行TMB计算的时候,有的方法会把热点驱动突变(比如EGFR p.L858R)去掉,有的则保留。有的会包含不改变氨基酸序列的同义突变,有的则不包含。这是为什么呢?在笔者看来,各家有各家的道理。从原理上讲,最后能够形成新的抗原的,应该绝大多数是来自编码区域的突变,而且驱动突变也一样会形成新的抗原。而有的方法中,之所以去除了热点驱动突变,其实是为了平衡Panel设计的偏向性。要知道,大多数的肿瘤Panel不是只为TMB设计的,而是为捕获热点突变设计的,TMB只是一个附属的产物。因此,Panel中产生热点驱动突变的概率肯定要高于整个WES的水平,而去除掉热点驱动突变,可以降低一定的偏向性。而至于计算同义突变,其中一个原因也类似,就是肿瘤的Panel一般都不大,可能能够检测到的非同义突变个数太少了,经常产生统计上的扰动(比如,1个突变和2个突变,只差了1,但是却差了一倍)。而加上同义突变,可以增加突变的数目,提高了统计的稳定性。当然,至于不同的方法倒底孰优孰劣,业界尚无一个具体的定论,也需要更多的探索。
TMB可以很好地预测免疫治疗效果没错,但是这个可是要求组织样本的啊,对于一些晚期患者没有条件获取组织样本,这可怎么办呢?自然而然,大家就能够想到使用血液样本来检测TMB,也就是blood TMB,简称bTMB. 在去年的ESMO上,就已经报道了bTMB的一些结果,其中包括POLAR和OAK研究,使用394基因的panel,将0.5%以上的突变进行计数,来计算bTMB。
而就在前几天,OAK的结果也正式发表在了《Nature Medicine》上,我们来先看一下文章中给出的图:
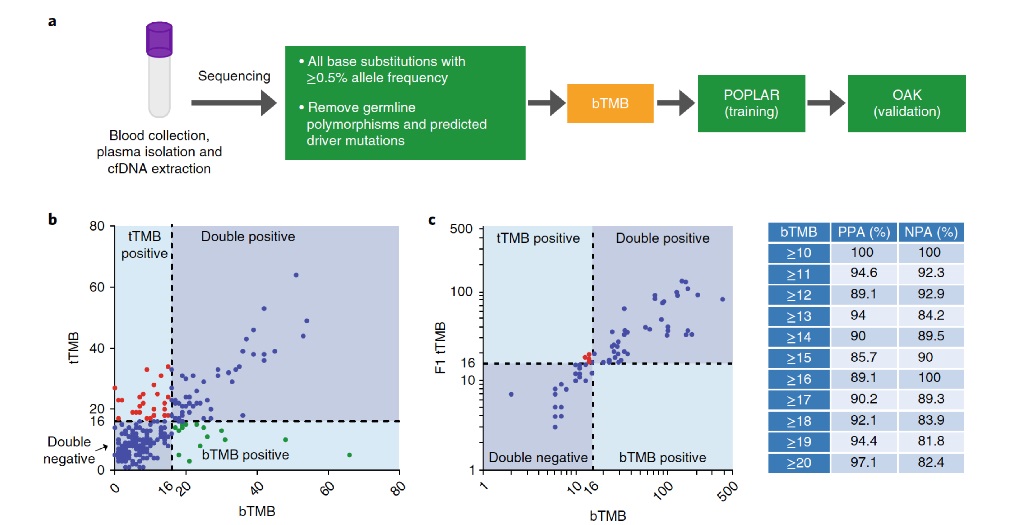
可以看出,虽然bTMB与TMB的关系不算完美契合,但是也算不错了。而从对阿特珠单抗的疗效预测来看,bTMB也是体现了一定的优势的,见下图:
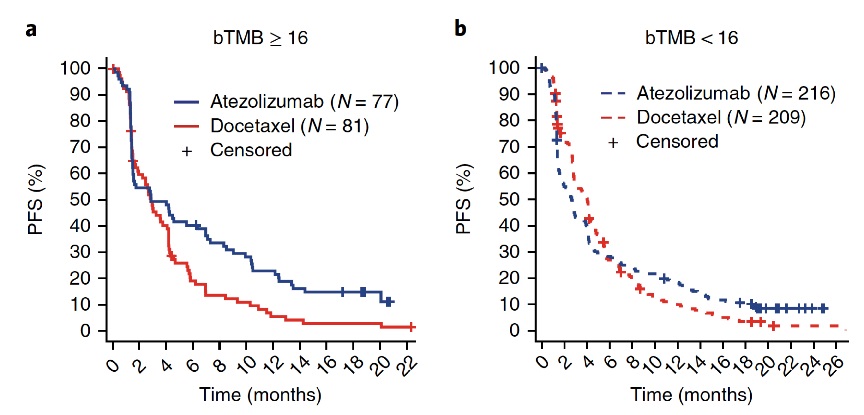
左图是bTMB大于等于16的,可以发现阿特珠单抗的PFS明显优于多西他赛,右图是bTMB小于16的,两条曲线就基本上靠近了。
因为bTMB的作用开始得到了一定程度的认可,我相信目前在国内也有很多家厂商开始提供bTMB的检测了。但是作为一个在测序和生信分析老司机,笔者还是有必要提醒一下。要想获得靠谱的bTMB,在测序中一定要使用双端样本index(即UDI,针对Illumina平台),否则你将无法排除Index Misassignment带来的样本间污染导致的大量假阳性超低频突变。同时,还需要使用UMI分子标签方法,以排除PCR, 和测序过程中带来的大量错误。
既然我们在谈免疫治疗,那如果没有比较给力的免疫系统,我想一切都是白搭的,毕竟外因需要通过内因起作用嘛。而免疫系统,就是那个最重要的内因。有一个指标,能够在一定程度上量化免疫系统的能力,那就是HLA的多样性。
2017年的一篇《Science》都报道了HLA多样性缺失会导致免疫治疗效果不佳。这项新的研究探究了1535名接受免疫检查点抑制剂治疗的癌症患者,并发现具有更多的HLA基因版本(即具有更大的HLA基因多样性)对这种治疗更好地作出反应。而几乎是同期的一篇《Cell》也发表了类似的观点,即HLA的杂合缺失(LOH)会导致免疫逃逸,其原理见下图:
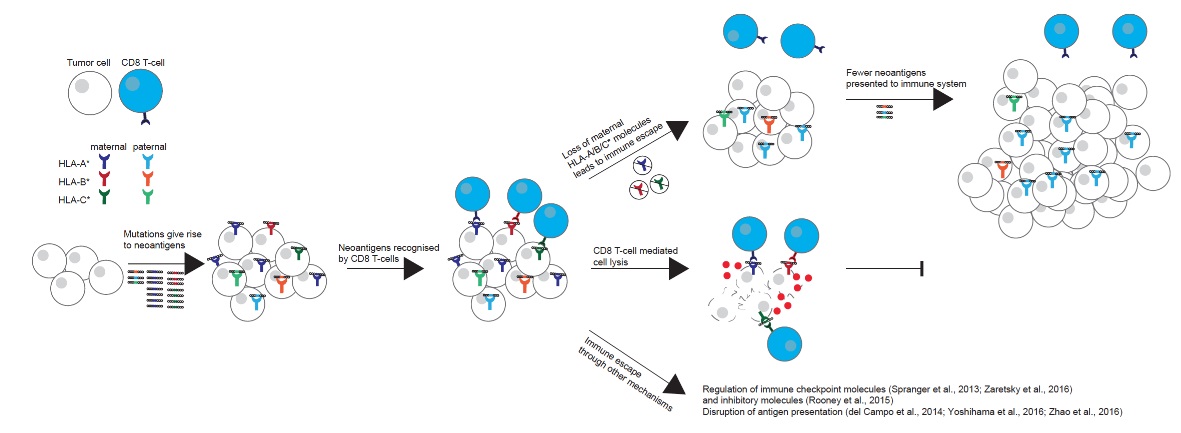
如图所述,如果丢失了来自父系或者母系的HLA基因片段的话,那将只有更少的抗原被呈递到细胞表面并被传送到免疫系统,从而引起免疫逃逸。
那怎么检测HLA的杂合缺失呢?其实NGS的方法是可以有能力检测分析HLA的LOH的,当然其中也有一个技术难题,即HLA是有大量的同源变体,需要仔细设计探针才能够比较好地捕获到HLA的基因片段。
免疫治疗是一个非常复杂的体系,它所对应的标志物也是五花八门,层出不穷的。在以上盘点的最主要的标志物类型之外,任何与肿瘤免疫反应体系相关的因子都可能成为标志物,这包括但不限于肿瘤的免疫微环境相关,肿瘤的免疫原性相关,以及一些重要的肿瘤免疫信号通路相关。
POLE基因的突变,被认为与免疫治疗的效果相关,因为POLE基因也是参与DNA修复的,所以它的突变与免疫治疗的效果相关的原理可能与MMR基因类似。一些其他参与DNA错误修复的TP53, BRCA1/BRCA2等类似的功能失活突变(例如移码),理论上也会有类似的效应,但是目前虽然有一些报道,但是还需要更多进一步的研究。
甲基化的分析结果也可以作为标志物,就在上周,《Lancet 呼吸医学》就发表了一篇新的文章,表示DNA甲基化可能成为PD-1免疫治疗最新预测标志物。该研究通过肿瘤组织DNA的甲基化芯片分析,发现了301个CpG岛的甲基化水平与非小细胞肺癌患者接受PD-1阻断治疗的临床响应显著相关。而基于这301个CpG岛甲基化水平组合而成的EPIMMUNE特征,则是无进展生存率 (PFS)和整体生存率 (OS)的独立预测指标,见下图。
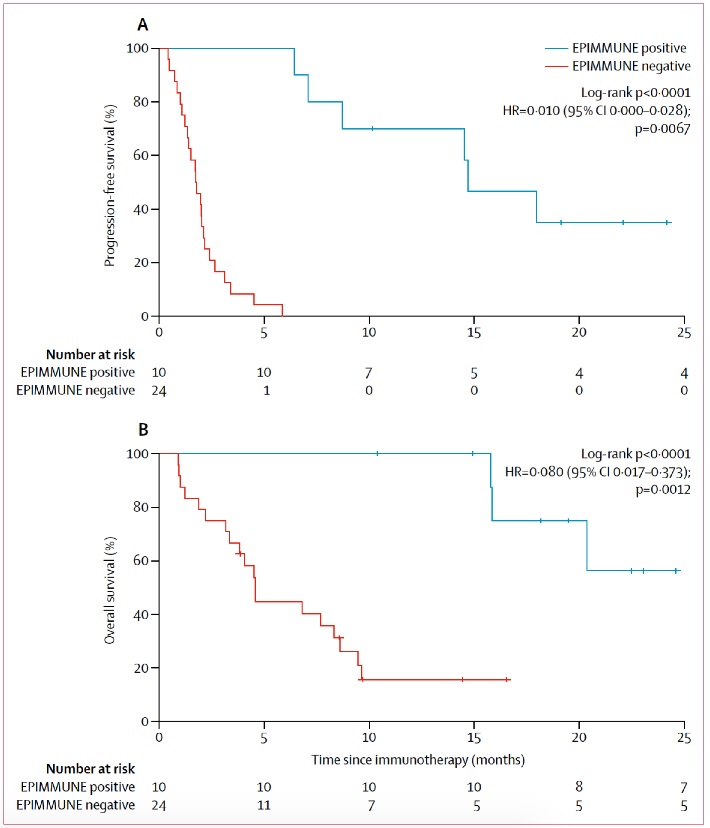
从图中可以看出,EPIMMUNE-阳性相比于EPIMMUNE-阴性的分组,无论在PFS和OS上都有明显的优势。
我们需要意识到,标志物之间往往不是独立的,而往往是存在千丝万缕的关系。例如,Fisher 博士进一步指出,MMR基因的突变不但和TMB以及新抗原有关系,实际上和PD-L1的表达以及淋巴细胞的浸润也非常有关系,它与PD-L1表达量以及TIL的关联性强度甚至大于肿瘤的类型。
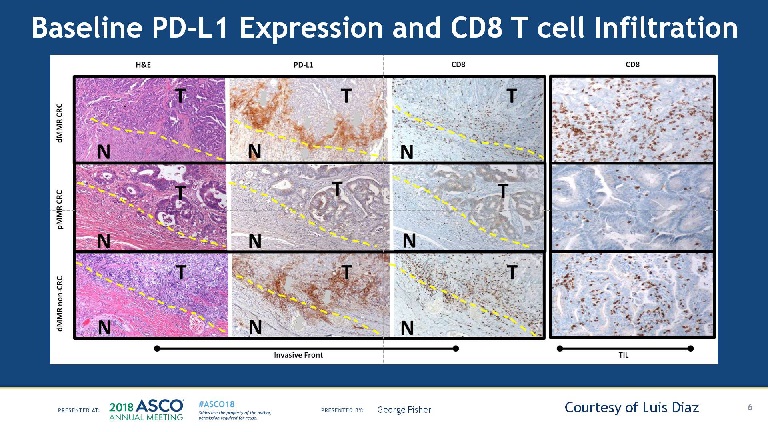
以上图为例,上面第一行是带有MMR缺陷,也就是dMMR的肠癌,第二行是MMR功能正常的肠癌,第三行是有dMMR的非肠癌。可以看到,从PD-L1的表达, CD8+细胞的浸润来看,第一行dMMR的肠癌和第三行dMMR的非肠癌是非常类似的,而第一行和第二行两个肠癌,因为一个是dMMR,一个是MMR正常,可以看出区别却非常大。
同样地,一项6万多患者的数据分析也表明,TMB和MSI之间,也有较大的关联。基本上来讲,就是MSI-H则TMB一般也高,反之则不然。
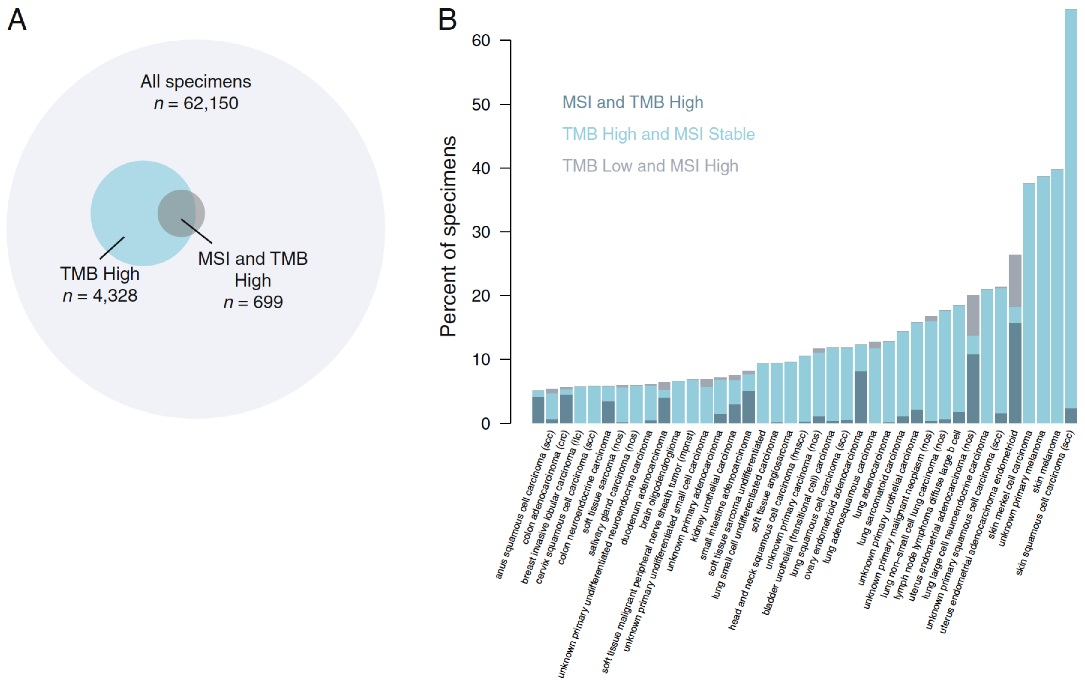
总之,综合考虑多个标志物的水平,肯定是会比只考虑一方面的标志物更为全面可靠。我相信,未来更优秀的预测方法,一定是提取多个维度的特征,进行机器学习建模,以得到最为优异的综合性标志物。
聊完了PD-1/PD-L1免疫检查点疗效预测的标志物,我们再来快速盘点一下,有哪些标志物可以用来评估疗效,监测病情发展,以及分析可能的耐药。
 疗效评估
疗效评估
假如患者已经开始使用上了PD-1类药物治疗,那有没有什么办法评估药物是否有效呢?我相信有很多小伙伴一定会想到影像学,因为通过影像学查看肿瘤的大小是最为直观的。
然而,影像学用于评估PD-1疗效时可能存在一个问题,那就是假性进展的问题。具体说来,因为免疫治疗会对免疫细胞进行招募,在肿瘤附近进行聚集,导致肿瘤在影像学中看起来反而变大了。显然,再取一次活检通常是不太现实的,那有没有办法区分真性进展还是假性进展呢?
一个标志物,要用于疗效评估,或者说是疗效监测,它首先肯定是要无创的,容易取材的。ctDNA可以从外周血中获得并进行超深度测序,实在是用于疗效评估监测最适合的标志物候选者。来自MD Anderson的Michael Overman博士在今年的ASCO上分享了一个使用ctDNA评估纳武单抗治疗的MSI-H的结直肠癌患者的研究结果。
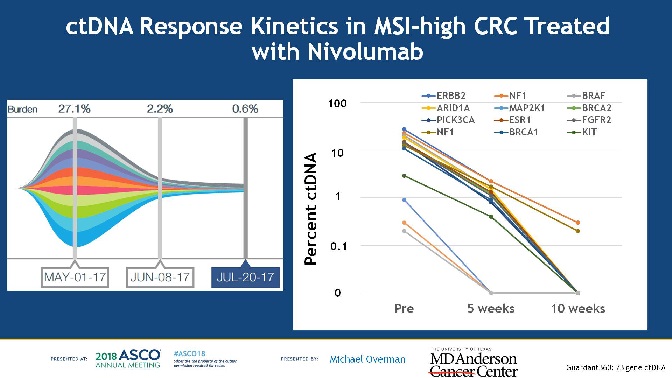
可以看到,随着免疫治疗的进行,肿瘤的负荷在不断变小,同时一些重点位点的基因突变的频率也在快速下降。这表明,可以使用ctDNA来对肿瘤免疫治疗的效果进行评价。我们期待未来看到更多的相关研究结果。
对,没错,又是这个CD39,在上文中,我们已经提到了它可以联合CD8作为疗效预测标志物。还是上述的研究表明,患者在接受PD-1类抗体治疗后,外周血中的CD39+CD8+的T细胞含量会有显著变化。一名结直肠癌患者在接受了帕博利珠单抗治疗之后,产生了快速的免疫响应。研究人员对其外周血进行分析之后,发现患者外周血的CD8+ T细胞高表达CD39。所以推测,外周血中CD8+ T细胞中CD39的表达量有潜力用于预测其疗效。当然,此类研究的样本还太少,需要经过更大的样本验证之后才能够得到明确。
耐药是永恒的话题,靶向治疗会耐药,免疫治疗也一样会。耐药可以分为原发性耐药(Primary),适应性耐药(Adaptive),以及获得性耐药(Acquired)。
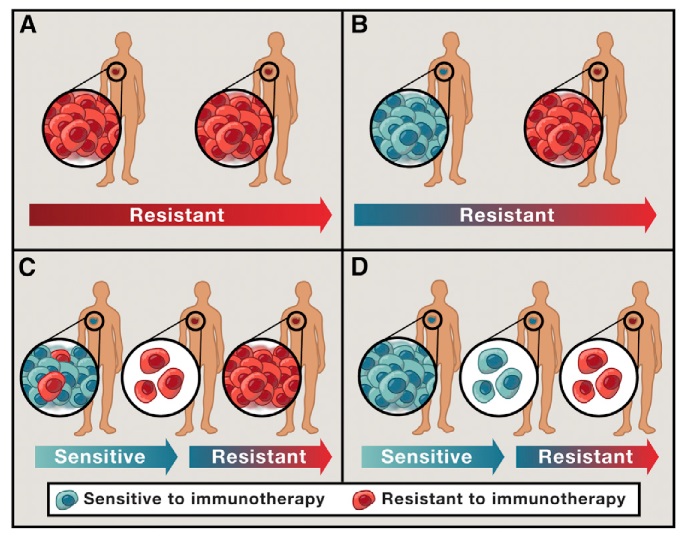
以上四个场景中,A是原发性耐药,肿瘤根本对治疗没有反应。B是适应性耐药,因为肿瘤一开始是完全有反应的,但是后面被一些免疫检查点或其它因素关闭。C在治疗之前就存在着耐药突变,只是可能不是主克隆,在经过治疗的选择压力之后,进化成为了主克隆,所以表现出肿瘤耐药。D则是完全的获得性耐药,肿瘤从完全反应的状态产生了突变,从而获得了耐药性。
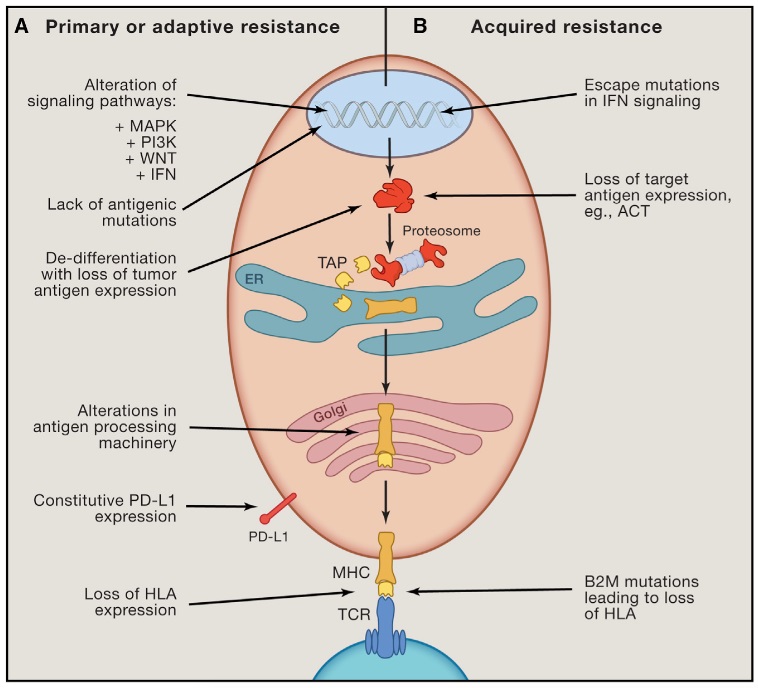
从上图可以看出,原发耐药和适应性耐药的原因有很多,例如没有抗原性突变,HLA多样性的缺失等等。当然我们更关注的是获得性耐药,这里主要列了三类,一个是IFN信号通路的变化,二是B2M突变导致的HLA多样性缺失,还有就是肿瘤抗原的表达下调或缺失。在此我们只讲一下IFN和B2M,而肿瘤抗原表达下调导致的耐药性,目前看来还缺乏足够多的证据,作为标志物还不太合适。
FN-γ一般由肿瘤中的效应T细胞或者是抗原呈递细胞呈递抗原时产生,并且募集其他免疫细胞,从而启动抗肿瘤增殖和引起肿瘤的凋亡效应,因此IFN-γ信号通路处于抗肿瘤的中心位置。在2016年的《Cancer Discovery》文章上,就阐述了IFN-γ信号通路基因JAK1/2功能失活性突变可导致PD-1阻断治疗获得性耐药的机制。
B2M是HLA-I型进行折叠并转运到细胞表面所必须的,所以B2M的突变,会导致HLA的多样性缺失,甚至导致整个HLA-I型分子缺失,从而导致免疫治疗的耐药性。
肿瘤的免疫治疗是一个非常复杂的体系,光靠一篇文章是无法进行完美的盘点的。虽然本文罗列了较多疗效预测,用药评估和监测,以及耐药等方面的标志物,对于比较重要的预测不良反应的标志物,包括对于超进展等方面的标志物,本文尚未进行探讨。而且这两个方面也还缺乏足够多的论文证据,这就需要更多的大牛进行更多的研究。

















