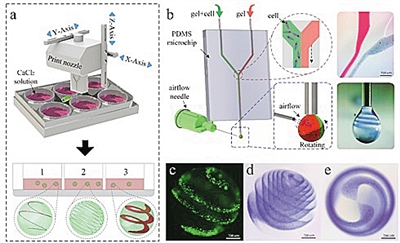
气流辅助异质螺旋微球类器官的成型工艺

3D打印的螺旋异质凝胶微球
3D打印活体器官的梦想尽管遥远,但人类正向它一步步逼近。浙江大学机械工程学院贺永教授课题组发明了一种新型生物3D打印方法,能够操控不同种类的细胞形成特定结构的微球,进而长成具有生物活性的微组织。相关论文近日作为封底文章刊登在《SMALL》杂志上。
这一方法将为体外重建类器官、开发更为高效的器官芯片、实施更有效的细胞治疗等提供有效路径。
“模型”很多,至今无法植入
如果有一天,人类能够自由制造人体“零件”,更换器官就像更换电池一样方便,器官移植的来源就不再成为问题。但要真正实现活体器官的3D打印,路途还是有点远。
在3D打印的“初级阶段”,人类已经能够精准地打印牙齿、骨骼等组织结构相对简单的零部件,并应用于临床。颅骨损伤的病人,也可以通过3D打印头盖骨实现整形。如果要把打印目标扩展到人体所有“零件”,挑战就大多了。
首先,你要保证人造器官能够适应人体的力学环境,不能太硬、太软或者塌陷;其次,器官要能够存活并发挥特定的功能。比如,尽管3D打印的心脏“模型”已经很多,但至今没有一个真正的3D打印心脏能够成功植入生物体。
“我们试试能否先实现一个小目标,打印生物活性的微组织。”贺永说。
天然的生物组织比我们想象的复杂。比如血管是由成纤维细胞、平滑肌细胞、内皮细胞等组成的复杂结构。平滑肌维持了血管的弹性,内皮细胞分泌生长因子防止血液凝固。“如果要‘打印’血管,就需要将不同的细胞打印到一起,形成特定的结构。”贺永说。
靠一股气流,三维结构在微小空间成型
三年前,课题组开始了尝试。他们将不同的细胞分别用水凝胶包裹制成“生物墨水”,在一个微流控芯片喷头的控制下,一点点“吐”出多组分细胞微滴。
“用这台机器,我们‘打’出了血管化的骨组织。”贺永说,他们第一次用两种分别混合了骨髓间充质干细胞和人脐带静脉内皮细胞的“生物墨水”,同步打印出了带螺旋形的微球。其中,骨髓间充质干细胞可定向分化为成骨细胞,内皮细胞会形成血管化细胞。经过几天实验室培养,呈螺旋形血管化的成骨类器官就形成了。
用这种方法,实验室还做出了玫瑰花、螺旋状微球、太极等造型的颗粒,直径在200微米左右。总之,可以操纵细胞形成特定的“队形”。
“生物墨水”的组分之一水凝胶是有名的“软”物质,要对这么软的材料进行精准操控,是一项颇为艰巨的挑战。课题组用一阵“风”巧妙解决这个难题:在一股微气流的吹动下,喷头吐出的液滴不会马上落下,而是会旋转起来,此时再根据数学建模控制不同组分生物墨水下降的方向,就能形成精致的立体结构。这个过程,有点像我们在转动的蛋糕模具上裱花,让不同细胞形成特定的立体“编队”。
“这一技术的精度可以达到单细胞分辨率。”贺永说,与现有生物制造方法相比,其特点是首次实现了在微小空间内三维结构的可控成型,为体外重建复杂类器官提供了新思路。
有望应用于器官芯片、细胞治疗
我们可以构造出具有活性的迷你生物组织,用于药物筛选的器官芯片。”贺永说,另一个用途是细胞治疗。当前细胞治疗的一大难点在于直接注射的细胞容易被自身的免疫细胞吞噬,因此只对某些特定的疾病有效。“我们或许能打印出具有特定功能的细胞微球,细胞抱团在血管中行进,就不怕被吃掉,而且一到目的地就可以马上发挥作用。”贺永说。
这项研究在医学上非常有意义:目前人们已经可以通过干细胞培养出各种类型的细胞,但接下来,我们还需要让这些细胞形成特定的组织结构。“生物体内的细胞与细胞之间有丰富多样的连接方式,它们并不是‘一锅粥’,因此,怎样让细胞形成不同的层次、组织甚至器官,是一项非常重要的课题。”

















