美国食品与药品管理局(FDA)于今日发布年度新药报告,披露2018年批准新药59款,为历史新高:1/3 是 First-in-Class 的原研药,24%突破性疗法,70%+ 加速审批渠道!

2018年关键词:
强势的创新与进展
FDA下属药品评价与研究中心 (CDER)共计新药审批,包含新药申请(NDAs)下的新分子实体(NME),也可以作为生物制剂许可申请(BLAs)下的新治疗生物制剂。
CDER 2018年的所有新药批准 Source:FDA
#年度纵览
59款!
与上年度同比增加13个,获批数量是历史新高,远超2009-2017年平均的33款,FDA报告称2018年为”医药强势创新与进展的一年“!
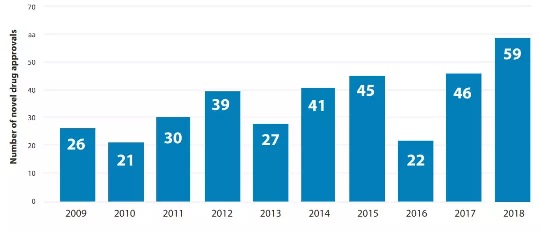
CDER 最近10年的新药批准走势 | Source:FDA
亮点解析
CDER于2018年批准的许多新型药物以其潜在的积极影响和对优质医疗护理和患者治疗的独特贡献而着称。
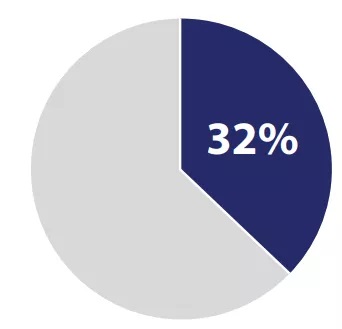
#一类新药(First-in-Class):32%
CDER将2018年批准的59种新药中的19种确定为一类药物,这是该药物对美国人健康产生强烈积极影响的一个指标。 这些药物通常具有与现有疗法不同的作用机制。
2018年度新药,一类创新药32% | Source:FDA
FDA于2018年批准的新型药物被认定为一流的药物:Aimovig,Crysvita,Elzonris,Galafold,Gamifant,Lucemyra,Lutathera,Onpattro,Orilissa,Oxervate,Palynziq,Poteligeo,Tavalisse,Tegsedi,Tibsovo,Tpoxx,Trogarzo,Vitrakvi Xofluza。...
#加快审批更加普遍,
占比增至73%
CDER在2018年使用了多种监管途径来提高效率并加快新药的开发和批准。这些途径采用了一系列方法,包括CDER员工与药物开发人员之间的更多互动,更大的项目设计灵活性以及缩短的申请审查时间表。
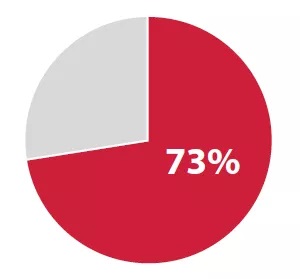
2018年度新药,整体使用快速发展和审查方法的占73%| Source:FDA
创新机制,加速审批成为业界主流共识!
2018年59种新药批准中有43份(73%)被指定为快速通道,突破,优先审查和/或加速批准的一个或多个加急类别,包括FAST Track(41%),Breakthrough Therapy(24%), Accelerated Approval(7%)。
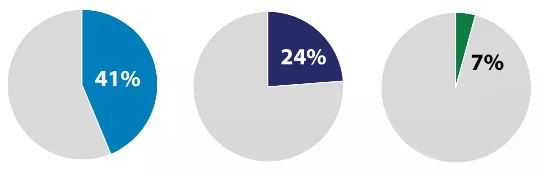
各快速审批渠道一览:FAST Track(41%),Breakthrough Therapy(24%), Accelerated Approval(7%)| Source:FDA
使用至少一种加急批准方法在2018年批准的新型药物是:Aemcolo,Ajovy,Biktarvy,Copiktra,Crysvita,Daurismo,Diacomit,Doptelet,Elzonris,Epidiolex,Erleada,Firdapse,Galafold,Gamifant,Krintafel,Libtayo,Lorbrena,Lucemyra, Lumoxiti,Lutathera,moxidectin,Mulpleta,Nuzyra,Omegaven,Onpattro,Orilissa,Oxervate,Palynziq,Poteligeo,Revcovi,Symdeko,Takhzyro,Talzenna,Tegsedi,Tibsovo,Tpoxx,Trogarzo,Vitrakvi,Vizimpro,Xerava,Xofluza,Xospata和Zemdri。
#备受关注罕见病:占比53%
2018年,CDER的59种新药中有34种(58%)用以治疗罕见病或“孤儿”疾病(患者数量20万或更少)。 患有罕见疾病的患者,通常很少或没有可用于治疗其病症的药物。
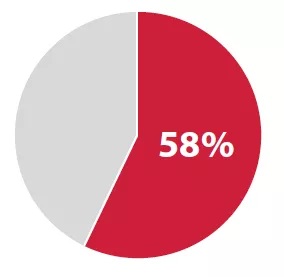
2018年度新药,与罕见病相关药品占比:58% | Source:FDA
2018年以孤儿药物名称批准的新型药物是:Asparlas,Braftovi,Copiktra,Crysvita,Daurismo,Diacomit,Elzonris,Epidiolex,Firdapse,Galafold,Gamifant,Krintafel,Lorbrena,Lumoxiti,Lutathera,Mektovi,moxidectin,Omegaven,Onpattro,Oxervate,Palynziq,Poteligeo,Revcovi,Symdeko,Takhzyro,Tavalisse, Tegsedi,Tibsovo,Tpoxx,Trogarzo,Ultomiris,Vitrakvi,Vizimpro和Xospata。...
#美国优先
尽管FDA与其他国家的监管机构的监管程序差异很大,但2018年批准的59种新药中有42种(71%)在获得其他国家批准之前在美国获得批准。
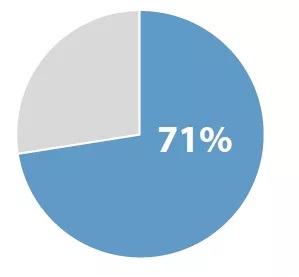
2018年度新药,美国优先批准的药品占比:71% | Source:FDA
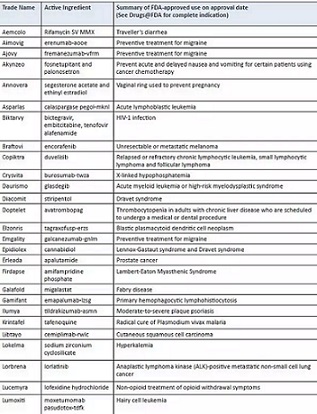
2018年首次在美国批准的新型药物是:Aemcolo,Aimovig,Ajovy,Akynzeo,Annovera,Asparlas,Biktarvy,Braftovi,Copiktra,Daurismo,Doptelet,Elzonris,Emgality,Epidiolex,Erleada,Gamifant,Ilumya,Krintafel,Libtayo, Lumoxiti,Mektovi,moxidectin,Nuzyra,Onpattro,Orilissa,Palynziq,Pifeltro,Revcovi,Seysara,Symdeko,Takhzyro,Talzenna,Tavalisse,Tibsovo,Tpoxx,Trogarzo,Ultomiris,Vitrakvi,Vizimpro,Xerava,Yupelri和Zemdri。
新药列表
美国CDER1995-2018年批准的新药数量

59款新药陆续获批,涵盖多个治疗领域
2018年FDA批准的新药

2018年FDA获批新药涵盖多个疾病领域(肿瘤、艾滋病、抗感染、偏头痛、罕见病等),针对不同疾病的临床需求。值得关注的是,在获批新药中,有32个孤儿药,总数超过获批品种数量的一半,可见美国在孤儿药研发领域的重要性。其中在肿瘤免疫领域,共计批准了23款新药,说明抗肿瘤和免疫调节药物是现在研发最热的点。
2018年获批新药的治疗领域

99个ANDA批文获批
2018年FDA批准的ANDA


2018年,中国药企在美国FDA一共获得99个ANDA批文,其中80个ANDA批文为已经批准,19个为暂定批准。这些国内药企中迎来了不少新面孔,如以岭药业、天津天药、山东新时代、海南双成、博雅欣和等。而老牌国际化药企则稳扎稳打,依旧是国产药品冲向国际的主力军。其中东阳光、人福医药、华海药业分别获得15个、13个、11个ANDA号,取得了非常不错的成绩。复星医药通过收购印度Gland Pharma,进一步扩展了自己国际化的脚步,该公司2018年获得美国ANDA批文9个。图表中标红的数据为暂定批准的ANDA,FDA的暂定批准意味着:由于专利权和/或独占权(exclusivity)的原因无法在美国上市,但它符合在美国上市的FDA质量、安全和有效性标准。
2018年各药企ANDA获批情况

总的来说,2018国内企业获批的ANDA批文创了历史新高,这是企业自身国际化需求的体现,也受到国内一致性评价政策的影响。中美双报的潜在红利,公司自身宣传的需求等诸多因素让不少药企赴美申报ANDA批文。然而在当前仿制药市场大变的情况下,积极布局高壁垒、高收益的品种方能在这场没有硝烟的变革中生存下来。
展望

2018年是新药蓬勃发展的一年,我们为一日千里科技进展欢呼;
正如FDA摘要所描述:
虽然CDER在2018年批准了59种新药,比去年任何一年都多,但CDER一如既往地关注批准的医疗价值,而不是数字。 批准了的许多已获FDA批准的药物的还有适应证拓展的新用途,新配方和新剂型,这些药物将有助于促进患者护理....这些都可以增加患者获得治疗的机会并降低患者的成本。
这些新的批准将使患有各种罕见疾病,神经系统疾病,传染病,癌症和许多其他疾病的患者受益。