根据英国《自然》杂志24日在线发表的一项遗传学最新研究成果,美国科学家利用CRISPR基因编辑技术,于实验室小鼠中成功开发出基因驱动系统。这一研究结果不但将改良小鼠模型,还有助于科学家研究复杂的遗传疾病。
基因驱动,即让特定基因有偏向性地遗传给下一代,使它们的遗传率高于随机几率,即所谓的“超孟德尔式”遗传。人类近来在昆虫中开发出了有效的基因驱动——2018年9月,基于CRISPR的新基因驱动机制,导致携带疟疾的笼养蚊子种群完全崩溃,甚至可让蚊子走向灭绝。但是由于遗传机制的差异,这种系统尚未在哺乳动物中成功开发。
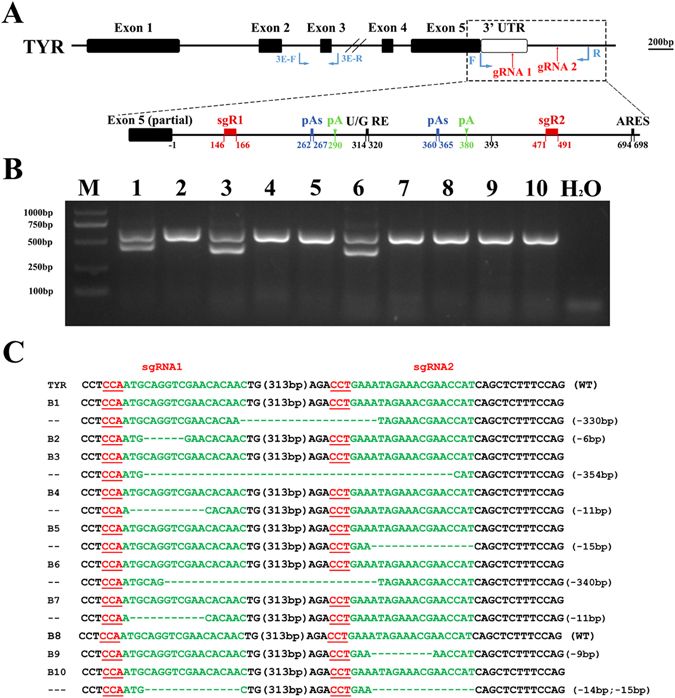
此次,美国加州大学圣迭戈分校研究人员金佰利·库珀及其同事,在实验室雌性小鼠中开发出了一种基因驱动系统。他们使用被称为“基因剪刀”的CRISPR-Cas9进行基因组编辑,来提高小鼠后代遗传酪氨酸酶基因(Tyr)中被特定编辑过的一个等位基因的可能性,具体做法是在配子生产和胚胎发育的不同阶段进行编辑,以优化基因传递。虽然该策略在雄性生殖系中不成功,但在雌性生殖系中,Tyr等位基因的遗传率增加了。研究团队报告说,他们测试的最有效的策略平均会将单个目标等位基因的遗传率从50%增加到70%左右。
该研究意味着,基因驱动作为一种用于增强特定基因变异在种群中遗传性的策略,其可行性在实验室哺乳动物身上得到了证明。而在将基因驱动用于控制野生小鼠种群之前,还需要开展进一步的工作。
研究人员总结表示,未来仍需增加雄性和雌性小鼠后代的基因遗传频率,但此次研究所实现的效率,足以满足很多实验室的应用要求。