随着生物医学技术的不断进步,药物发现靶标的整体蓝图不断揭示(见“【First-in-class药设系列】创新药物研发时代的大数据中心TCRD及对新靶标选择的挖掘”)。虽然我们看到靶标远景并不会枯竭,但回到眼前,未来10年内最值得投资的靶标类型是什么?这将对我们当前布局创新药物研究起到极大的指导作用。温故而知新,对当前已上市药物靶标情况的分析将大大帮助我们去理解现有的药物靶标的成功所在,并思考为什么是相关疾病中是这些靶标率先被验证药物在其上的治疗作用1。
最早进行这项工作的是1997年Drews和Ryser,他们提出了药物靶标中存在偏好性蛋白家族(privileged protein family)这一概念2,2006年Overington等人系统分析了当时324种明确机制的上市药物靶标特征3,进一步印证了药物发现中privileged family的存在。2010年以来,随着新靶标和First-in-class药物上市的比例不断增加,针对疾病的靶标重要性和如何选择的难题再次摆在我们面前。近来,Overington等通过定义上市药物的效应靶标(efficacy target),再次探索了在privileged family里选择靶标进行药物研发对于投资的风险。
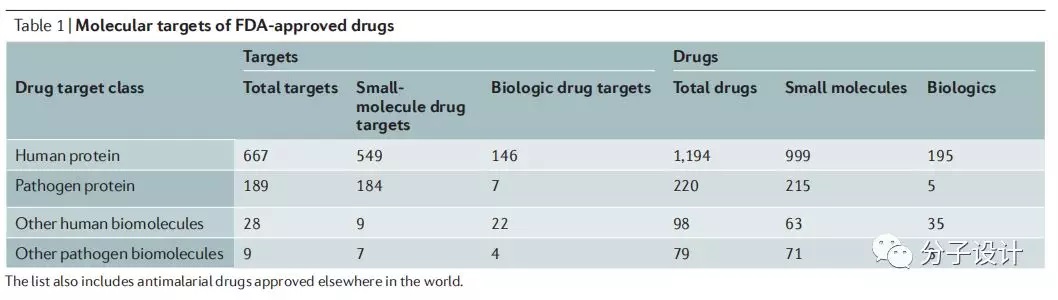
效应靶标(efficacy target)是指在体内药物直接作用且发挥治疗效果的蛋白或其他生物大分子(如DNA,RNA,heparin等)。除了效应靶标外,药物进入体内还往往结合一些其他生物分子,对于治疗带来辅助或副作用。通过对ChEMBL、DrugCentral和canSAR数据的分析整理,发现1578个FDA批准的药物,主要作用于总共893种人或病原体来源的生物分子,其中包括人基因组编码的667种蛋白和189种病原体蛋白的效应靶标。
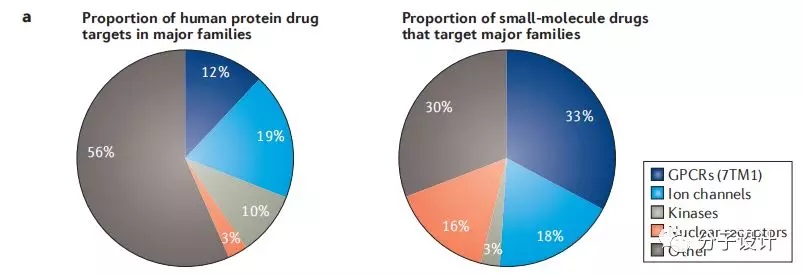
根据ChEMBL的靶标分类系统,GPCRs、离子通道、蛋白激酶和核激素受体是目前上市药物的四大类privileged target families(图a),共占所有人类蛋白靶标的44%(GPCRs:12%;离子通道:19%;激酶:10%;核受体:3%),约70%的小分子药物(GPCRs:33%;离子通道:18%;激酶:3%;核受体:16%)作用于这些privileged families发挥治疗效应。特别要注意的是,激酶抑制剂药物在小分子(少)和靶标(多)之间的巨大差异主要是由于其选择性问题,几乎所有激酶抑制剂都存在着同时作用于多个激酶靶标的现象。造成这种现象的原因很可能是由于激酶谱已研究较为彻底,当前激酶抑制剂的研究中全谱选择性评价已成为惯例,数据较翔实;而其他靶标药物尤其是1990年前上市的药物,对其探索靶标的选择性研究非常薄弱。随着Crispr/Cas9技术的快速普及,利用靶标敲除工具细胞系进行选择性验证将对更多类型靶标研究提供真实的效应靶标。
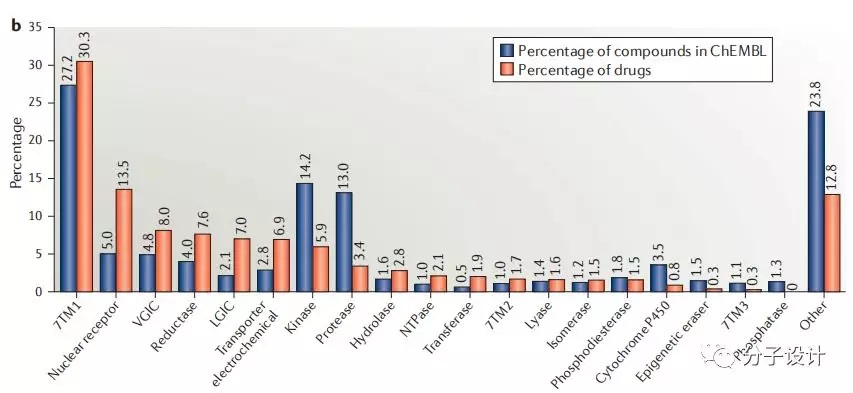
实际上,已知药物靶标的偏好和ChEMBL数据库中生物活性分子的分布趋势基本一致(图b),但其差异体现了过去10年对不同靶标投资的好坏。对于GPCR、核受体、电压离子通道(VGIC)、配体门控通道(LGIC)等靶标类型来讲,过去10年相同的投入比例产生的药物更多(橙色大于蓝色),收益更大,投入获得了持续的回报;而对于激酶和蛋白酶等靶标类型来讲,情况正好相反(蓝色大于橙色),投入回报处于相对的低潮。这个数据说明过去10年里靶标投资类型的风险,不可否认的是,当前很多在临床II期的激酶和蛋白酶等抑制剂在未来10年中可能会彻底改变这个比例,成为新的投资热点。
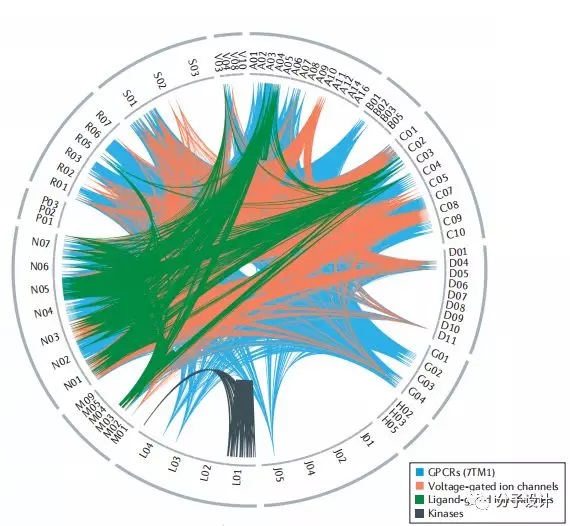
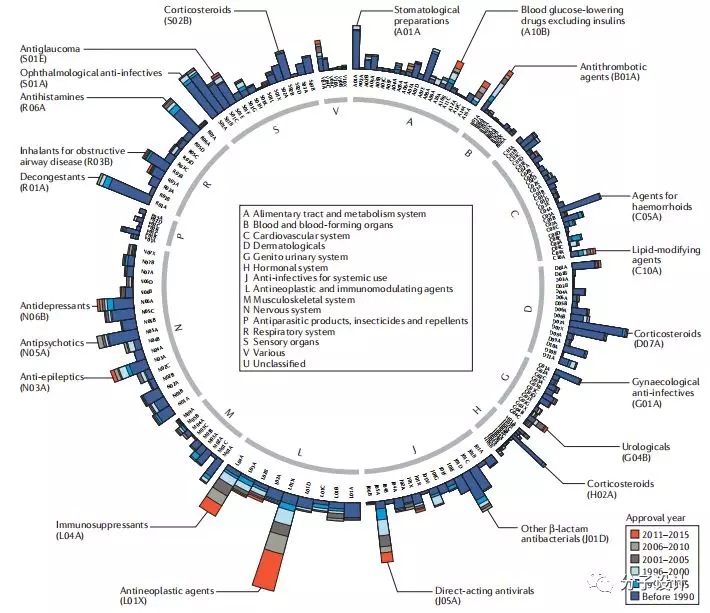
在疾病领域上,可以清晰地看出当前靶向心血管系统(C类)或皮肤系统(D类)药物的成熟期比较平稳,肿瘤学和免疫学领域(L类)药物创新当前正处在高峰,但抗寄生虫药物领域(P类)发展的停滞和现有药物数量少。
在靶标和疾病关联层面,除了抗寄生虫药物(P类)和激素系统(H类)外,GPCRs几乎是每个疾病类别下小分子药物作用的靶标,而作用于蛋白激酶类的小分子药物仅占2.4%,几乎都是抗肿瘤和免疫调节药物(L类)。说明如果未来一旦肿瘤和免疫系统疾病获得较好治疗后,再投资激酶类靶标将会存在极大风险,而GPCR类靶标仍可以寻找新的不同系统的适应症。同时,在肿瘤类疾病里的154个上市药物中,26个是细胞毒药物,38个是广泛细胞毒和部分作用于蛋白靶标,5个作用机制未知,85个药物是通过机制明确的效应靶标发挥作用。这当中病人来源肿瘤驱动新靶标的识别对药物发现起到了重要作用:比如2002年malignant melanoma中BRAF的识别最终于2011年发现了BRAF抑制剂vemurafenib的上市;non-small-cell lung cancer中EML4-ALK的识别推动2011年ALK抑制剂crizotinib的上市,因此从肿瘤病人中获得的新靶标对于未来10年的创新药物研发具有极其重要的源头意义。
综上所述,通过对当前上市药物及其靶标进行了全面分析,再次确认了过去10年内privileged family靶标家族在不同疾病领域内的药物研发主导地位。更为重要的是,针对不同人群疾病,科研院所/国内外药厂可以选择投入/产出比高的靶标类型进行药物发现,这是从过去10年First-in-class药物上市过程中获得的宝贵经验,也为下一个10年布局全新靶标进行投资提供了重要参考。
参考文献:
1. Santos, R., et al., A comprehensive map of molecular drug targets. Nat Rev Drug Discov, 2017. 16(1):19-34.
2. Drews, J. & Ryser, S. Classic drug targets. Nat. Biotechnol. 1997, 15:1350.
3. Overington, J.P., B. Al-Lazikani, and A.L. Hopkins, How many drug targets are there? Nat Rev Drug Discov, 2006. 5(12):993-6.

















