目前已获批的PD-(L)1抑制剂均为静脉注射,随着疗效的提高,会有越来越多的患者需要长期用药,静脉注射就显得没那么便利。是否有不需要住院、患者接受皮下注射后就可以回家的PD-(L)1抑制剂?
目前在研的、走在前列腺的有一款PD-1抑制剂(辉瑞 PF-06801591)和PD-L1抑制剂(思路迪 KN035)。
本届ASCO,思路迪公布了其KN035在中国实体瘤人群中的I期数据。(摘要号:2608)。研究编号为KN035-CN-001,评估KN035单药皮下注射给药在中国实体瘤患者中的安全性、耐受性(MTD)、PK和初步疗效。研究分为三个阶段(剂量爬坡、剂量扩展-1和剂量扩展-2)。本次报道了剂量爬坡的数据。
3+3剂量爬坡设计。计划剂量为0.1mg/kg,0.3mg/kg,1.0mg/kg,2.5mg/kg,5.0mg/kg和10.0 mg/kg,每周皮下注射。(每周给药的方式似乎不是很便利)
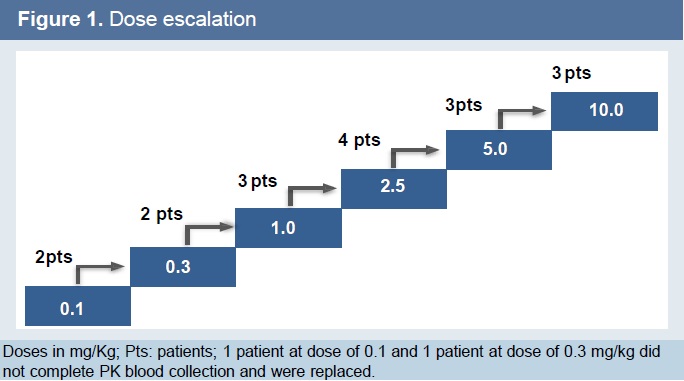
截至2019年5月,共入组17例患者,多为既往2线及以上标准治疗失败的患者。中位KN035用药时间为18周(1-71),16例患者已经中断治疗,其中15例因为疾病进展,1例为撤回知情同意。
肿瘤类型:3例胆管癌,2例肾细胞癌,3例尿路上皮癌,3例胃肠肿瘤,2例肝细胞癌,2例甲状腺癌,1例非小细胞肺癌和1例卵巢癌。
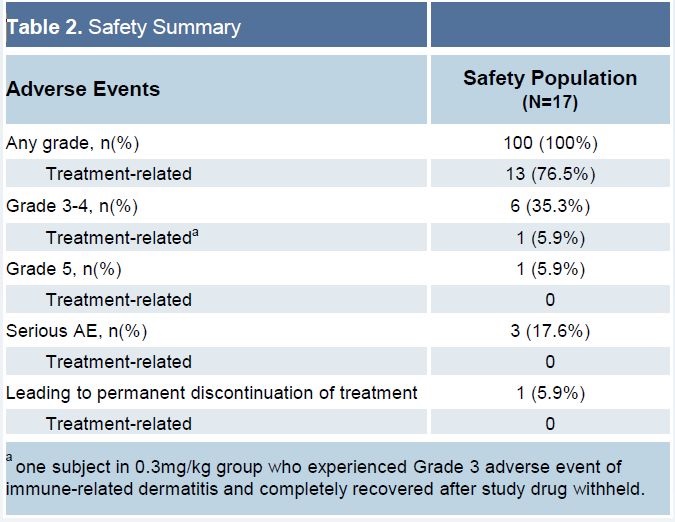
安全性,未观察到DLT,未观察到治疗相关SAE,未观察到5级治疗相关AE。
仅观察到1例3-4级治疗相关AE,为3级皮炎。
常见的治疗相关AE
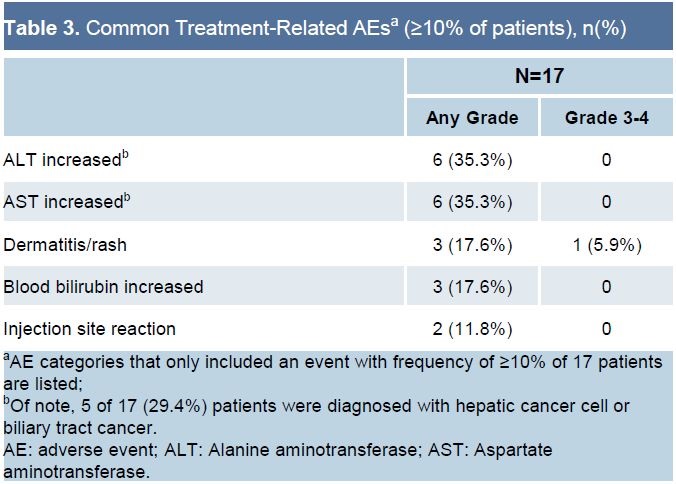
仅就这项研究的安全性数据,已经好过之前报道过的PD-(L)1抑制剂的早期数据,不知道更好的安全性未来是否会成为皮下注射的优势。
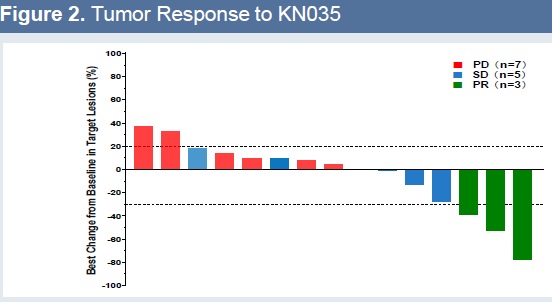
疗效:15例患者疗效可评价,3例(20%)达到确认的部分缓解,包括1例2.5 mg/kg组的肾细胞癌,1例5.0 mg/kg组的肝内胆管癌和1例10.0 mg/kg组的胆道癌。5例患者取得疾病稳定。
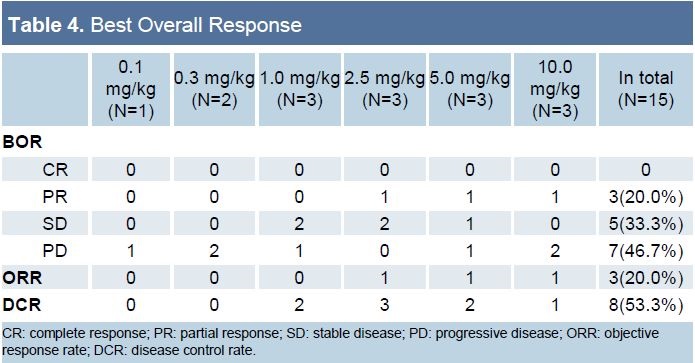
KN035的初步疗效和安全性都不错,目前正在国内开展一项MSIH实体瘤的2期和一项胆管癌的3期研究。
辉瑞的皮下注射PD-1抑制剂PF-06801591今年5月30日在JAMA ONC发表了其I期剂量爬坡的数据。
(JAMA Oncol.doi:10.1001/jamaoncol.2019.0836)
研究分两组,每3周一次静脉注射0.5mg/kg、1mg/kg、3mg/kg或10mg/kg PF-06801591,或每4周一次皮下注射300mg PF-06801591。
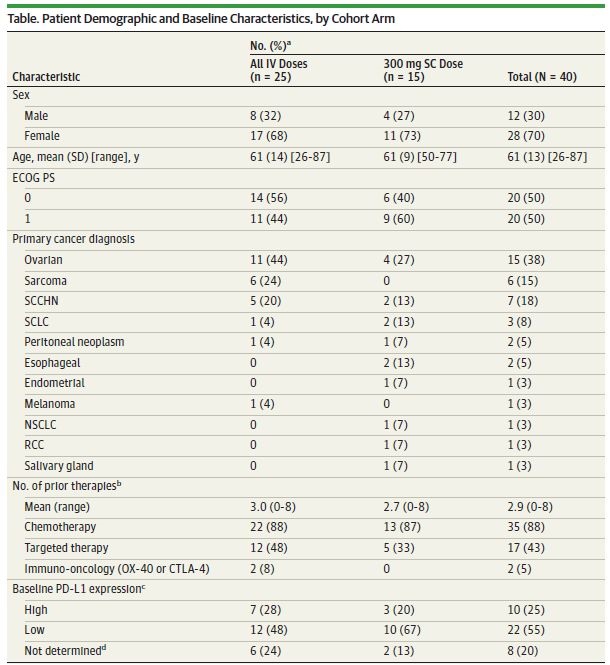
入组40例患者,25例静脉注射,15例皮下注射。
患者特征如下。
入组最多的是卵巢癌和肉瘤,大部分为3/4线标准治疗失败后的患者。
安全性:未观察到DLT,皮下注射组的中位治疗时间为2.1个月,治疗出现AE发生在所有15例皮下注射组患者,6例(40%)为3级及以上AE。
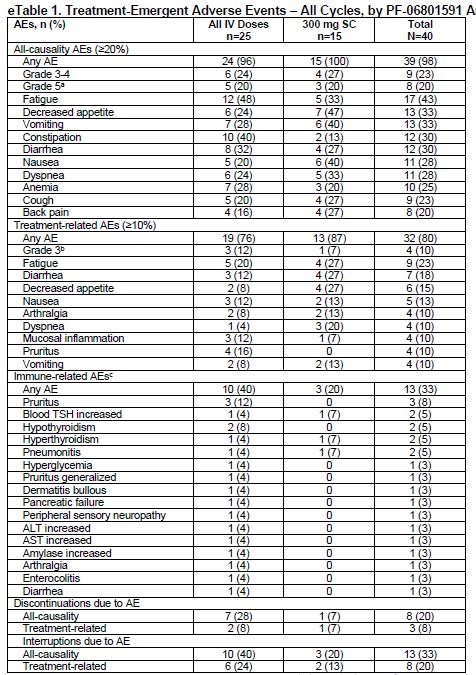
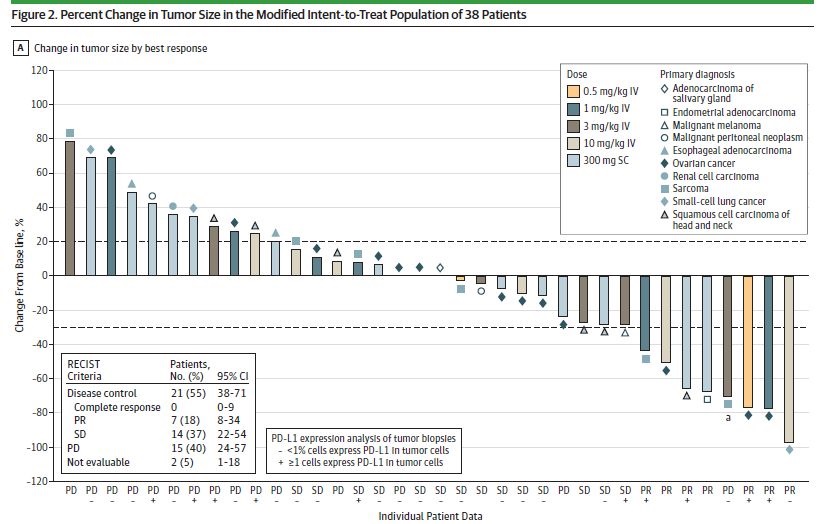
疗效:在38例疗效可评估人群中,ORR为18.4%(2例来自皮下注射组)。
部分缓解的患者为卵巢癌,头颈鳞癌,肉瘤,小细胞肺癌和微卫星高度不稳定的子宫内膜癌。疾病控制率为55.3%。
肿瘤负荷变化
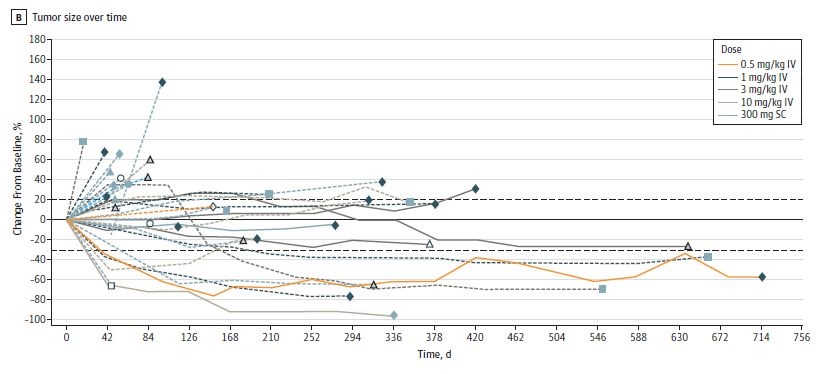
浓度时间变化
PF-06801591 30mg每月一次皮下注射的稳态暴露浓度在1 mg/kg和3 mg/kg每三周一次静脉注射的浓度范围内,这也和既往抗PD-1抗体的疗效获益浓度一致,即进一步增加剂量也不会带来疗效的提高。
PF-06801591 在其I期研究中同样取得了不错的疗效和安全性结果,并且相比KN035,其1个月皮下注射给药一次也是个优势。目前PF-06801591 在非小细胞肺癌和尿路上皮癌中进行探索。

















