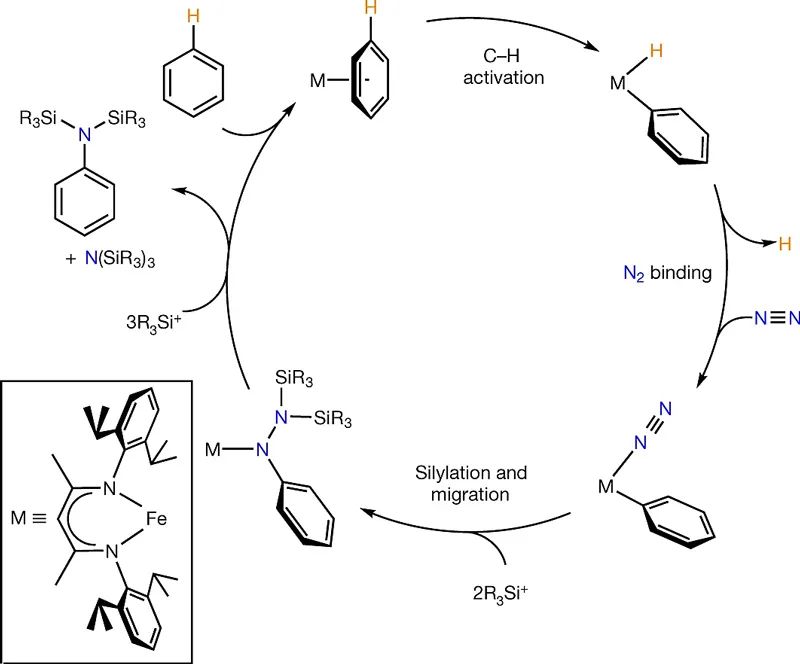
提起氮气(N2)大家都不陌生,小学科学课里就已经讲过,我们呼吸的空气中约78%都是它。如此丰富的含量,使得氮气成为制备含氮化合物的理想原料。不过,氮气“生性寡淡”——N2分子中的N≡N三键是自然界中最强的化学键之一,想要顺利活化N2一直都颇具挑战。从农业中重要的铵类氮肥到药物中常见的氮杂环,含氮化合物在人类社会的方方面面都非常重要,因此固氮一直是化学领域的一个重要研究课题。虽然化学家已经报道了若干能把氮气直接还原为氨的催化体系,但是通过固氮来形成碳氮键(C-N)却不太容易。传统策略中用N2作为氮源来合成含氮有机物,一般要在还原性条件下把N2转化为氮亲核试剂,然后与碳亲电试剂反应来形成目标C-N键。但是,强还原性条件下,碳亲电试剂往往也会被还原,使得该策略在大多数情况下并不可行。针对此问题,近年来一直围绕铁配合物的相关性质展开研究的美国耶鲁大学的Patrick L. Holland教授课题组设想能否直接诱导N2与简单的烃形成C–N键,而无需对烃进行预先官能团化(如将其转化为亲电试剂)?近日,他们在Nature 上报道了铁配合物顺序活化苯和N2以制备苯胺衍生物的新型固氮反应策略。具体而言,通过C-H键活化,铁配合物对苯环C-H键进行氧化加成,形成含有铁-碳键的中间体;随后该中间体与N2结合,在合适Lewis酸作用下,由于N2的亲电性大大增强,使得苯环可以发生迁移反应形成肼中间体;在还原性条件下,肼的N-N键断裂,生成苯胺衍生物;同时在过量Lewis酸的条件下,释放出金属配合物进入下一个催化循环(图1)。
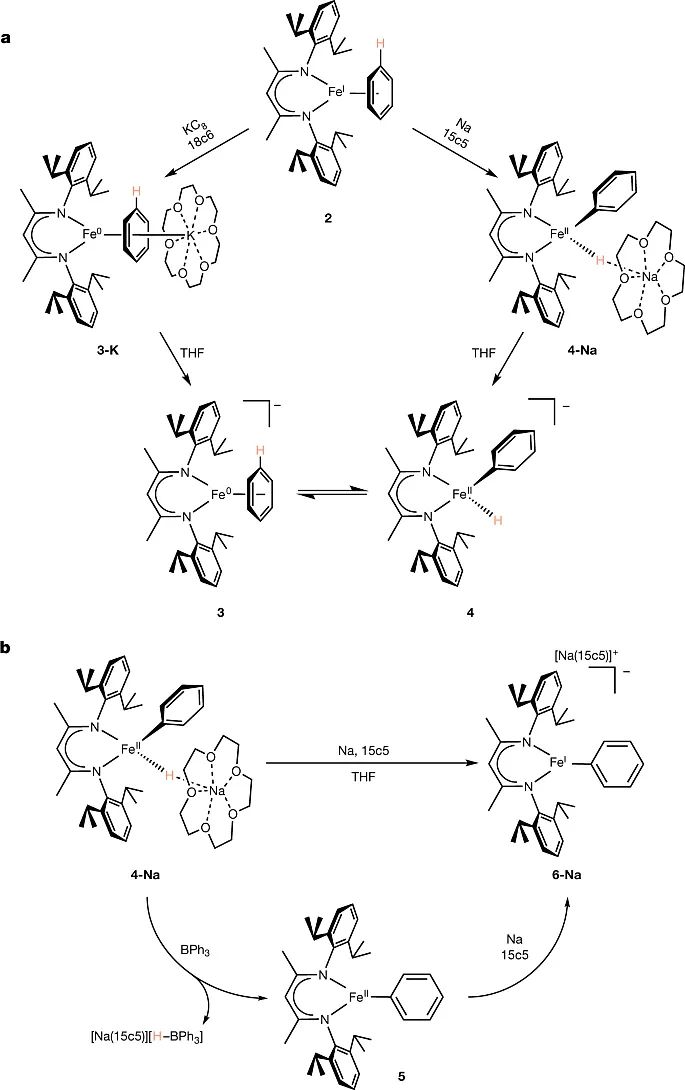
为了研究该策略的可行性,作者首先进行了当量反应研究(图2)。首先,他们合成了铁-苯配合物LFe(η6-C6H6)(2),然后分别在不同的还原条件下来还原该配合物。在KC8和18-冠-6(18c6)条件下,配合物2可以被还原为零价铁配合物LFe(η4-C6H6)K(18c6)(3-K);而在钠和15-冠-5(15c5)条件下,配合物2则被还原为二价铁配合物LFe(H)(Ph)Na(15c5)(4-Na)。通过分析3-K和4-Na 的穆斯堡尔(Mössbauer)谱和密度泛函理论计算,表明了3-K和4-Na具有不同的铁原子成键环境。在4-Na中苯环上的一个C-H键断裂,形成了一个碳-铁键和氢-铁键;而3-K中则是苯环的π电子与铁原子配位。此外,在氘代溶剂C6D6下,作者对3-K和4-Na的稳定性进行了核磁追踪实验。结果显示若干小时后,它们氢谱的一些核磁峰消失了,表明了这些铁配合物的苯环和氘代溶剂C6D6进行了交换。同时在3-K的核磁谱图中出现了4-Na的峰,而4-Na的核磁谱图中也出现了3-K的峰,这表明配合物3和4之间存在化学平衡。该化学平衡证实了铁对苯环C-H键的氧化加成是可逆的(图2a)。当向4-Na的THF溶液中添加金属钠和15c5时,在室温下静置几小时,4-Na的紫色溶液会慢慢变绿。核磁数据证明了一价铁配合物[LFePh][Na(15c5)](6-Na)的生成。当添加强Lewis酸BPh3时,4-Na中的氢负离子则被转移到BPh3上,生成已知化合物5和[Na(15c5)][H-BPh3],而5最终被3或者钠还原为6-Na(图2b)。
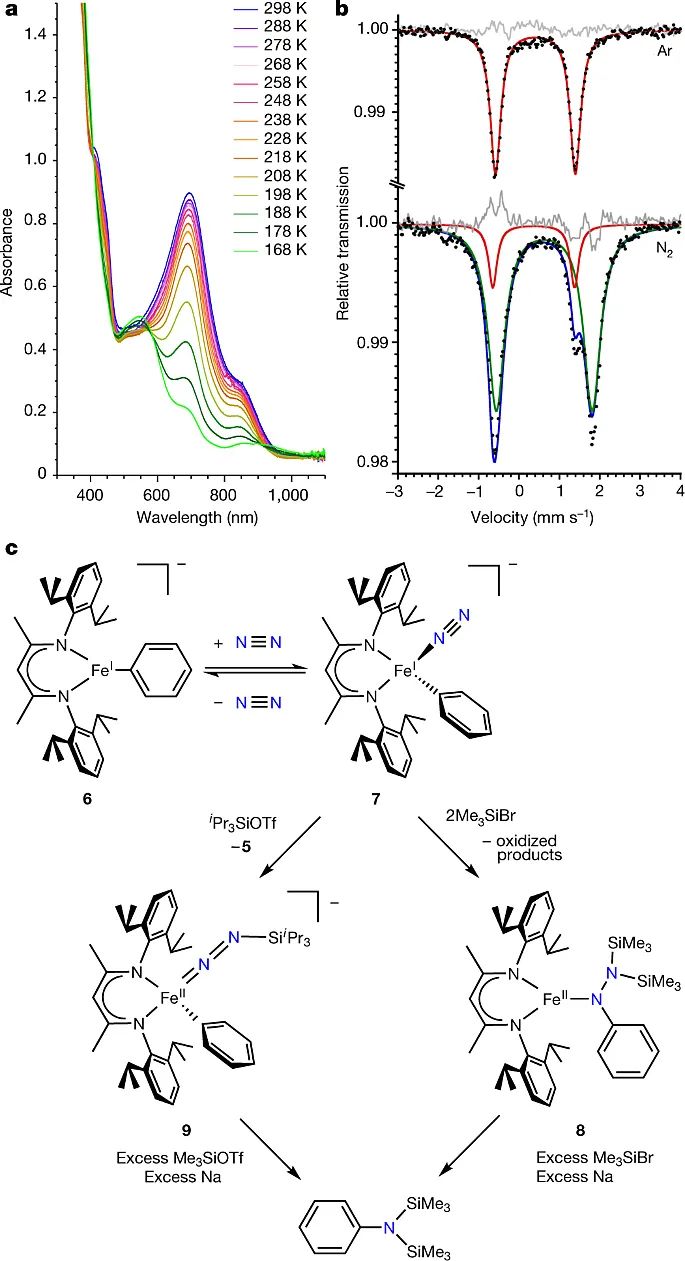
在研究了苯环的活化后,作者把目光转向了N2的活化(图3)。首先,作者在N2气氛下改变温度,发现6-Na的紫外可见吸收(UV-vis)光谱图和穆斯堡尔谱都会发生变化;而在Ar气氛下,相应的谱图都没有发生改变(图3a、3b),这表明铁配合物6-Na可以与N2结合。接着,作者进行了晶体学验证,即在-78 °C下将钾类似物6-K冷却3 h,得到N2配合物7-K,其X-射线晶体数据显示N2的一个氮原子孤对电子与铁原子配位,整个配合物为四面体构型(图4)。随后,作者向氮气配合物7-K溶液中添加了不同的硅基Lewis酸。当使用两当量Me3SiBr时,配合物7-K直接被转化为肼络合物LFe(N(Ph)N(SiMe3)2)(8),表明了烃基从金属中心迁移到N2的α-位,这是形成甲硅烷基化苯胺的关键之处。继续向8中添加过量的Me3SiBr和还原剂钠时,8则被还原为三甲基硅基保护的苯胺。如果向7-K中添加位阻更大的三异丙基硅三氟甲磺酸盐(TIPSOTf),配合物7-K则被转化为中间体9,其晶体结构显示苯基并未迁移,表明氮原子与硅基Lewis酸的配位发生在苯环迁移之前(图3c)。接着,向9中添加过量的Lewis酸Me3SiOTf和还原剂钠,9也会被还原为苯胺衍生物,收率14%。
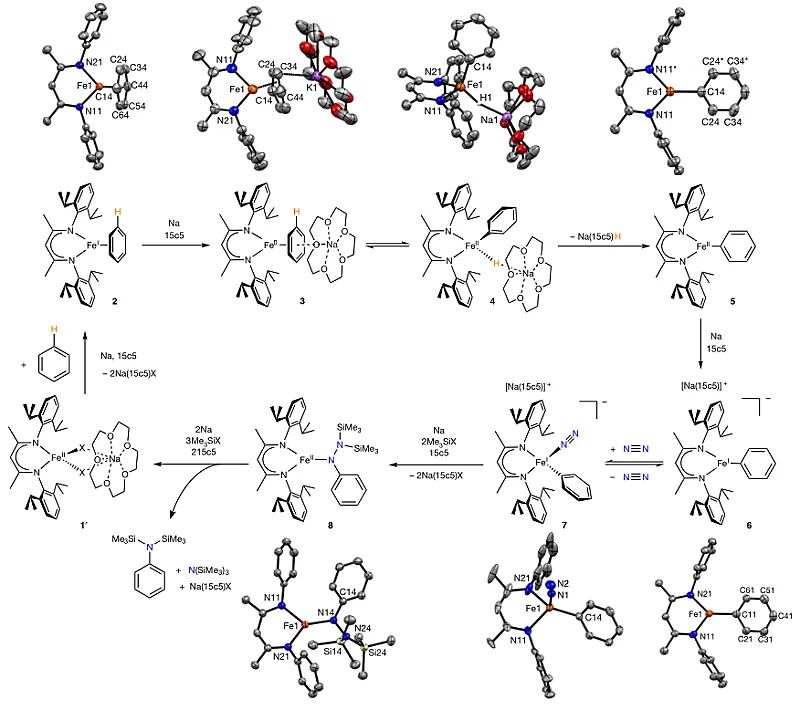
至此,虽然作者已经得到了目标产物苯胺,但是这些数据并不能说明该过程是一个催化循环的过程。为了回答该问题,作者向中间体8的溶液里添加了甲苯。因为最初的反应原料为苯,如果添加甲苯后也能得到基于甲苯的胺类衍生物,则证实了在第一轮反应后,铁配合物仍然具有反应活性,可以继续参与下一轮循环,从而符合催化的定义。实验结果表明,在添加甲苯后,得到了基于甲苯的胺化产物,从而证明了该反应是一个催化过程。在此基础上,作者提出了如下的催化循环(图4)。首先,配合物1'在钠还原条件下与苯反应生成一价铁中间体2,后者可以被过量的钠进一步还原为零价铁中间体3。通过零价铁中间体对苯环C-H键的氧化加成,3被转化为中间体4。随后,失去氢负离子生成中间体5,后者进一步被还原为一价铁中间体6,与此同时产生了一个可以与N2结合的空位,并与N2结合生成中间体7,在强Lewis酸作用下,N≡N三键被活化,中间体7上的苯环发生迁移进而生成中间体8。在还原性条件下,中间体8中的N-N键被还原从而生成目标产物(苯胺衍生物)和配合物1',后者继续参与催化循环。
在确定催化循环后,作者对两个起始原料苯环和N2进行了同位素标记实验(图5)。当在15N2气氛下进行反应时,气相色谱-质谱分析显示反应生成的苯胺衍生物Ph15N(SiMe3)2中含有15N,表明了N2是产物N原子的来源;同样,当使用C6D6作为反应底物时,反应生成的苯胺衍生物(C6D5)N(SiMe3)2中含有五个D原子,表明了苯是产物苯基的来源。最后,作者研究了其他常见的苯的同系物的反应活性。苯为底物时,目标产物苯胺衍生物的产率为68%;甲苯为底物时,产物为对位、间位混合物,总产率为61%;邻二甲苯为底物时,反应仅仅得到12%的间位胺化产物。
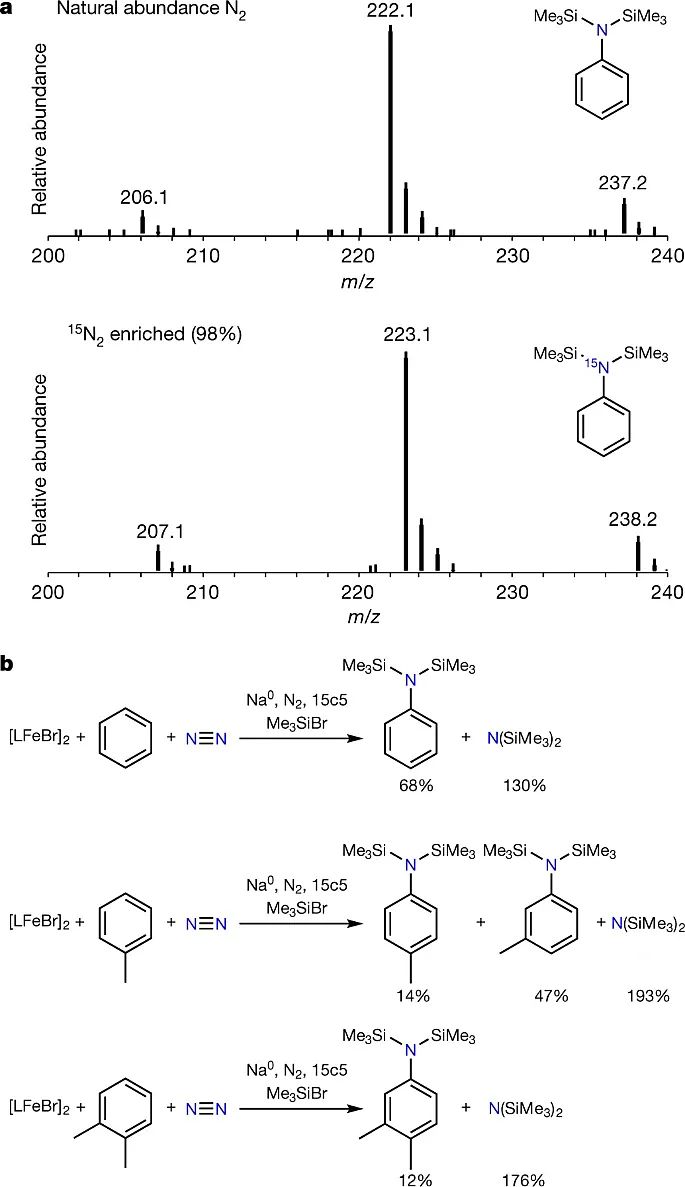
图5. 同位素标记实验及其他底物。图片来源:Nature
在这篇文章中,Holland课题组报道了一个铁配合物为催化剂、苯和氮气作为反应原料来合成苯胺衍生物的新反应。虽然之前报道的许多热驱动、电驱动和光驱动的金属偶联反应以及非经典的胺化反应(比如利用环己酮和胺来合成苯胺,Nature, 2020, 584, 75–81,点击阅读详细),已经大大简化了苯胺化合物的合成步骤,但是如果仅仅从反应原料的角度来说,利用苯和氮气来合成苯胺显然更具有吸引力。考虑到反应是用廉价易得的铁催化剂,该反应显然具有成为一个“Dream Reaction”的潜质。但是,该反应不仅需要用到活性极强的还原剂钠以及强Lewis酸,还需要严格无水无氧以及低至-100 ℃的反应条件,从实际操作角度来讲,该方法在短期内还不具有合成应用价值。尽管如此,该反应无论是在铁催化领域、固氮领域还是碳氢键活化领域,都可以称得上一个里程碑式的工作。最后分享一个小插曲。笔者在写这篇文章时,发现了文中图5b和正文中的相关描述并不一致。在正文中,作者意指图5b为C6H6 和C6D6(1:1)的胺化反应,图5c为苯、甲苯及邻二甲苯的胺化反应。但实际上图5b却是苯同系物的反应。显然,作者漏掉了5b并把5c标记成了5b。在发现该错误后,笔者向通讯作者Holland教授发送了提醒邮件,仅仅几分钟后,笔者就收到了Holland教授的回复,不禁感叹其效率之高。
Coupling dinitrogen and hydrocarbons through aryl migrationSean F. McWilliams, Daniël L. J. Broere, Connor J. V. Halliday, Samuel M. Bhutto, Brandon Q. Mercado, Patrick L. HollandNature, 2020, 584, 221–226, DOI:10.1038/s41586-020-2565-5
https://www.x-mol.com/university/faculty/1292 
















