8月22日,安斯泰来宣布其基因疗法管线主要候选产品之一的AT132(Resamirgene bilparvovec)研究中第三位患者死亡。该患者是之前披露中3名接受高剂量3x1014 vg/kg AT132治疗的老年组患者之一,这3名患者在给药后3-4周内开始表现出肝功能障碍迹象,所有三位患者都表现出存在肝胆疾病的证据。
今年6月,AT132因为发生第二起患者死亡案例而暂停临床研究。(详情请点击:第二起死亡案例,安斯泰来基因疗法AT132被叫停)

AT132来自于去年底安斯泰来对Audentes收购。彼时,安斯泰来溢价110%,耗资约30亿美元收购了这家基因疗法公司,该公司最重要的资产就是X-连锁肌小管性肌病(XLMTM)基因疗法AT132。2020年1月,Astellas正式完成了对Audentes收购。
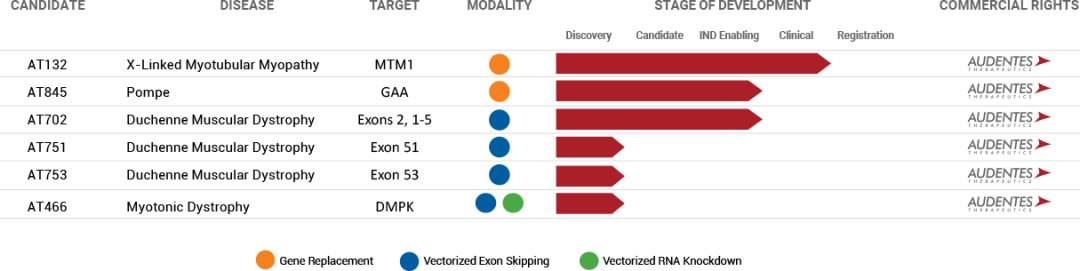
Audentes管线
AT132是Audentes的一款在研XLMTM候选产品,由一种AAV8载体内嵌MTM1基因功能性拷贝所组成,可以将正常的基因拷贝递送至患者体内,从而在骨骼肌细胞中转染和表达肌微管素。2018年8月Audentes公司公布了来自ASPIRO临床研究的首个剂量组的24周安全性、有效性和肌肉活检数据,结果积极。ASPIRO 是一项多中心、剂量递增1/2期临床研究,旨在评估AT132治疗12名5岁以下XLMTM患者的安全性和初步疗效。该研究总共对23名患者用药,其中6名接受了1x1014 vg/kg剂量治疗,17名患者接受了3x1014 vg/kg剂量治疗。AT132的临床前研究由Audentes与Genethon合作完成。
XLMTM是一种严重的,危及生命的罕见神经肌肉疾病。期临床特征包括肌无力,呼吸衰竭和早期死亡。据估计,患有该病的婴儿出生后18个月的死亡率达到50%,其余活过婴儿期的患者中,仅有75%能活到10岁。
研究表明,XLMTM是由MTM1基因突变导致肌微管素缺乏或功能紊乱所引起的。肌微管素是骨骼肌细胞正常发育,成熟和发挥功能所需要的蛋白质。
XLMTM给卫生系统带来了承重负担,80%患者需要呼吸支持,大多数患者需要胃造瘘管营养支持。对于多数患者来说,运动能力的发育延迟或完全丧失。目前除了呼吸和营养支持外,该病没有任何其他的治疗办法。
近期,基因疗法负面消息不断。3天前,FDA拒绝了BioMarin革命性的血友病A基因疗法Valoctocogene Roxaparvovec的BLA,并要求完成III期临床的2年随访,令人大跌眼镜(详情请点击:再次暴击!FDA拒绝BioMarin血友病A基因疗法的上市申请)。
本月中旬(8月18日),Poseida Therapeutics向美国证券交易委员会(SEC)提交的一份文件中披露显示,该公司的一款靶向PSMA的自体CAR-T疗法---P-PSMA-101在转移性去势抵抗性前列腺癌的I期临床试验已被搁置,原因是参加该项试验的一位患者死于可能与P-PSMA-101有关肝衰竭,目前直接引发原因尚待一步研究。
如今,AT132的第三名患者死亡,基因疗法安全性问题凸显。目前,基因疗法大多采用AAV载体技术,但为了实现更好的疗效,许多疗法不得不选择采用更高剂量进行治疗,例如Solid Biosciences旗下的DMD基因疗法SGT-001。随之而来的风险收益变得难以预测。
EndPoints News主编JohnCarroll在评论安斯泰来基因疗法第二起死亡案例时曾表示,Audentes所使用的AAV8载体应当引起其他生物技术公司的警惕,这不是第一次发生高剂量AAV载体基因疗法造成SEAs和死亡事件。
基因疗法先驱James Wilson此前突然辞去了在Solid公司顾问委员会的职务,原因是他与他的团队进行了一项大剂量AAV载体递送SMN矫正基因的研究。该研究为动物实验,使用了3只恒河猴和3只猪。结果显示,其中一只接受2x1014 GC/kg剂量表达人SMN蛋白的AAVhu68载体注射的恒河猴出现了肝脏严重受损后休克的严重危机,这迫使研究人员不得不对其实施安乐死。其余两只恒河猴虽然存活下来,但也出现了中毒反应。三只接受高剂量注射的猪也被事实安乐死,其中一只出现共济失调,另两只出现神经症状。James Wilson在接受福布斯采访时表示,“虽然这仅仅是来自小规模动物试验的结果,甚至这些试验一开始也不是为了安全性评估而设计的,但也正是如此,在有限规模的试验中发生的毒性事件更令人担忧。”
载体选择一直以来都是基因疗法所面临的重要挑战之一,疗法的风险收益比很大程度上是由此决定。基因疗法全身性治疗由于需要更大的剂量才能发挥效果,因此由病毒载体所引发的安全性风险也急剧上升,成为阻碍基因疗法发展的主要障碍之一。

















