近日,炙手可热的靶向蛋白降解疗法(PROTAC)再度聚焦了全行业的目光。PROTAC领域的先行者——Arvinas公司公布了其PROTAC蛋白降解剂ARV-471和ARV-110的最新临床结果。这也是靶向蛋白降解疗法取得的最新临床积极结果。每一个新领域冉冉升起绽放光芒之前,都有着暗夜中漫长的积累和探索,当此际,让我们看一看蓄势待发的PROTAC赛道上,有哪些机遇和挑战正等待着我们?
PROTAC技术是通过泛素-蛋白酶体系统(UPS)诱导靶向蛋白降解的一种全新技术。区别于传统的占据驱动(occupancy-driven)的药理学原理,事件驱动(event-driven)的PROTAC技术具有诸多优势,比如具有高活性、高选择性,催化降解作用模式,靶向不可成药靶点等。
PROTAC的作用机制
PROTAC ,全名Proteolysis Targeting Chimera,称为蛋白靶向降解嵌合体,其分子具有双特异性,共由三部分组成。它的两端各带有一个连接配体(binding ligand),一端可以跟泛素连接酶E3结合,另一端可以跟目标蛋白(POI,Protein of Interest)结合,中间有一个连接子(linker)将两个连接配体连接起来。这样的双特异性结构有什么样的意义呢?我们从蛋白质的泛素化修饰说起。
在天然的生物体反应中,泛素化修饰涉及泛素激活酶E1、结合酶E2和泛素连接酶E3的一系列反应:在ATP供能的情况下,泛素激活酶E1激活泛素,然后将其转移到泛素结合酶E2上,并通过硫酯键与E2的活性位点的Cys相连。E2可以直接将泛素转移到靶蛋白的Lys残基上,但一般靶蛋白的泛素化需要一个特异的泛素连接酶E3。E3泛素连接酶是具有特异性的,它一端能够识别特定的目标蛋白,一端定位E2,然后就可以为目标蛋白打上一个泛素“标签”。
上述级联酶促反应过程称之为泛素化,由于底物蛋白结构的不同,泛素可以连接的位点不一样,因此,不同的底物蛋白与泛素连接酶E3相遇,可以使得泛素化呈现单位点与多位点泛素化等不同的形态。当被标记了多个泛素后,目标蛋白会被蛋白酶体识别和降解。这个系统广泛存在于生命体的各个通路中,能够很好地调控蛋白质的水平。尽管这个依赖于ATP的蛋白降解通路在上世界70年代末已经被发现,但是直到30年之后才有了首个应用这一系统靶向降解蛋白质的报道。
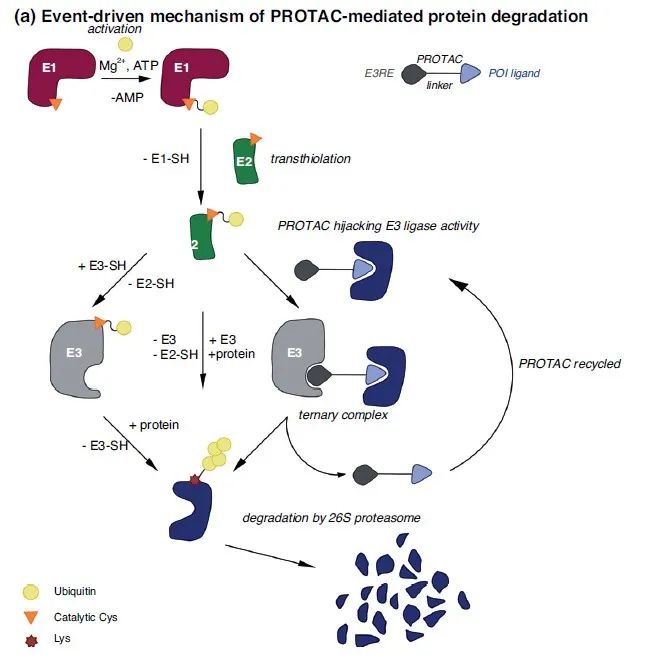
▲事件驱动的PROTAC分子的作用机理(图片来源:参考资料[1])
PROTAC的出现,为上述天然的生命体反应增加了人工靶向的可能——“想让谁降解,就让谁降解。”通过一端特异性的泛素连接酶E3配体,PROTAC成功“劫持”了泛素连接酶E3这个能够为目标蛋白打上“死亡”标签的关键角色;PROTAC分子另一端与目标蛋白结合,就可以将这两个分子在空间上拉近,形成一个三元复合物,从而通过一系列反应将目标蛋白泛素化。当目标蛋白被多次泛素化后,就能被人体内的蛋白降解酶(proteosome)识别到,从而被降解成多肽片段,彻底失去活性。在这个过程当中,PROTAC分子虽然介导了目标蛋白最终被降解,自身却并没有被消耗掉。它重新被释放,开始寻找下一个目标。
人们可以通过选择不同的连接配体,引导PROTAC分子有选择性地降解不同的目标蛋白;或者通过不同的泛素连接酶E3配体,调用不同的泛素连接酶E3;加上与不同的linker之间排列组合,造就了PROTAC分子与生俱来的百变潜力。
PROTAC的开发优势
相比传统小分子药物而言,PROTAC是一个非常新的治疗手段。PROTAC并不直接对致病蛋白发起攻击,而是以一种非常巧妙的方式调动了人体内天然的资源,对致病的蛋白进行干预和降解,与时下非常热门的免疫疗法有着异曲同工之妙。
PROTAC分子有一些显而易见的优点。相比传统小分子抑制剂,PROTAC在给药剂量方面优势明显,它可以重复循环发挥其功效,如同化学反应中常见的催化剂,所以理论上催化量的用量就足够了。这样有望大大降低用药剂量和浓度,从环保和对人体安全的考虑上都更有应用的潜力和优势。
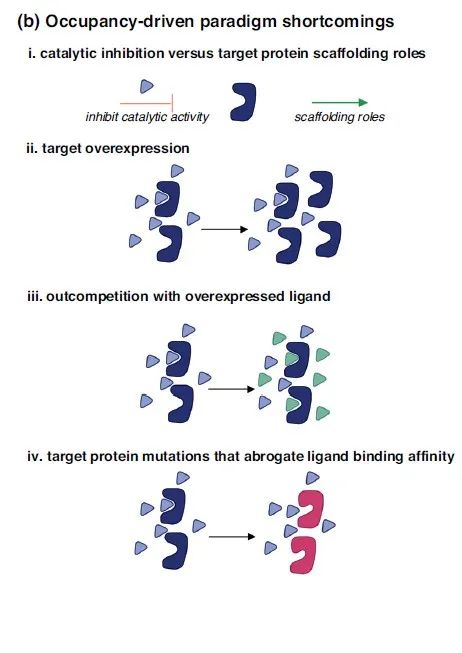
▲占据驱动原理的传统小分子抑制剂局限性(图片来源:参考资料[1])
传统小分子药物往往只能作用于有明确活性位点的目标蛋白,比如酶类,通过与其活性位点的结合,抑制其作用。这种作用方式在很多场景下并不能够达到应有的作用,比如有一些致病蛋白不是以酶的形式发挥功效的,类似翻译转录蛋白,细胞支架蛋白;此外,在目标蛋白过度表达、其他竞争性配体过度表达,或者靶蛋白的活性位点发生突变时,传统小分子抑制剂的作用都暴露出了局限性。还有一些蛋白是通过与其他蛋白发生相互作用来产生功效(protein protein interaction,PPI),因此难以被小分子药物识别活性位点并抑制其影响。在传统意义上这些蛋白质形态被认为是“不可成药”靶点,但是PROTAC分子的作用机制可以克服这些局限性。
PROTAC分子根本不需要与靶蛋白长久的结合以抑制其活性,而是诱导其被彻底降解,一劳永逸。随着人们对PROTAC的持续探索,越来越多的应用有望从概念走向现实。
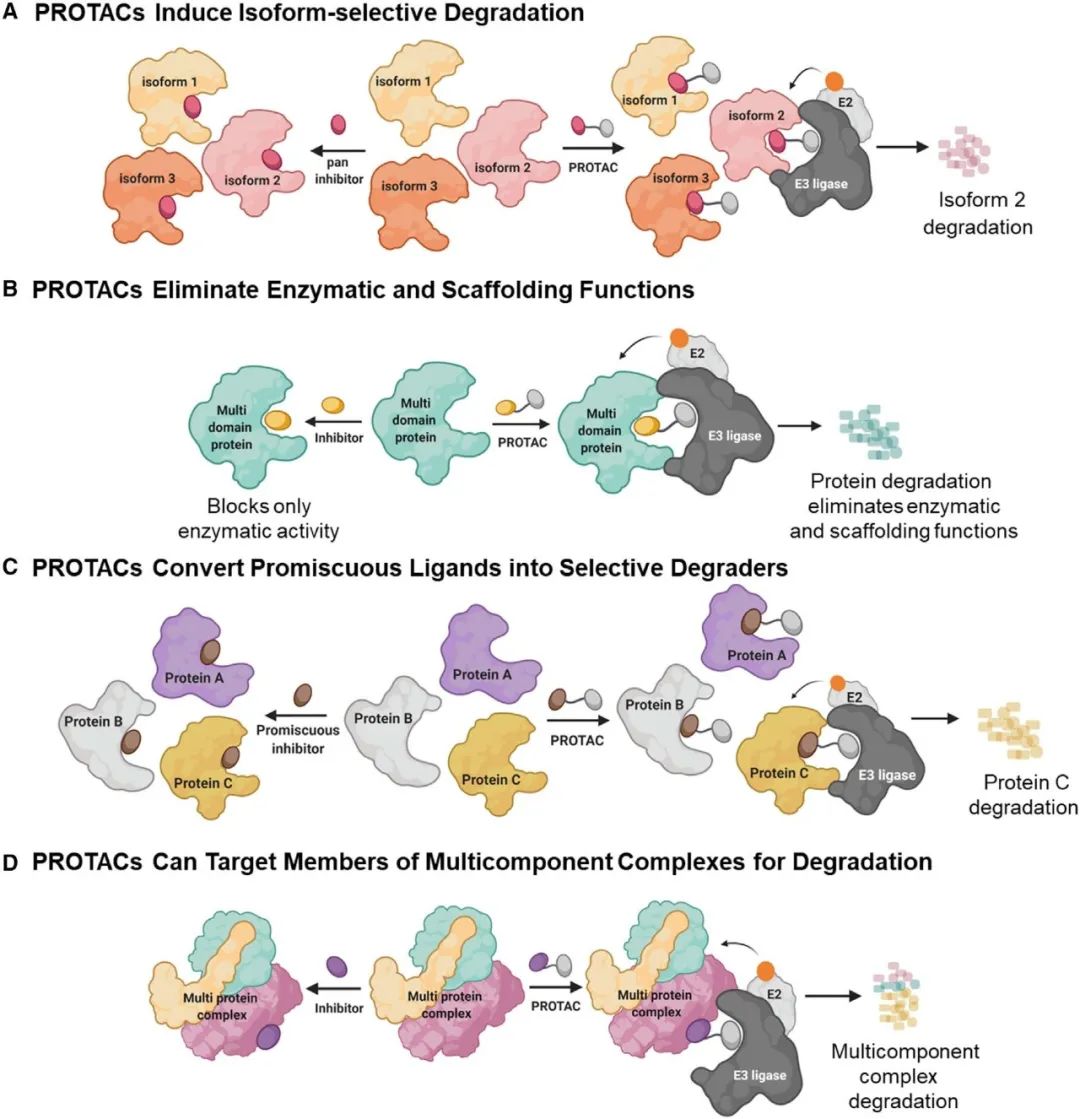
▲PROTAC的优势(图片来源:参考资料[2])
PROTAC的发展历程
2001年是PROTAC技术的元年,Craig Crews和Raymond Deshaies的团队在实验室中实现了利用泛素连接酶E3降解MetAP-2 enzyme,首次提出了PROTAC这个概念;2003年Crews团队通过微注射技术将PROTAC分子注射到一个完整的细胞中,实现了对雄激素和雌激素受体(AR和ER receptor)的降解,证明了PROTAC技术在细胞内应用的可能性;
2004年,在引入一条多肽链之后,首个可以穿透细胞膜的PROTAC分子被设计出来;同年,诺贝尔化学奖颁给了以色列科学家Aaron Ciechanover、Avram Hershko和美国科学家Irwin Rose,以表彰他们在泛素催化的蛋白降解方面做出的贡献。
2008年是一个分水岭,之前的PROTAC分子被称为第一代PROTAC,作为概念验证是成功的,但是其弊端也很明显:需要在相对浓度比较高的情况下工作,而且多肽链的细胞穿透力比较差。而在2008年,全部由小分子构建的PROTAC药物模式出现了,它们对细胞的穿透性很高,被称为第二代PROTAC。
2013年,关于PROTAC的体内研究表明PROTAC疗法可以抑制肿瘤的生长。此后进一步的研究表明PROTAC可以在非常低的浓度下,比如纳摩尔级浓度下工作。
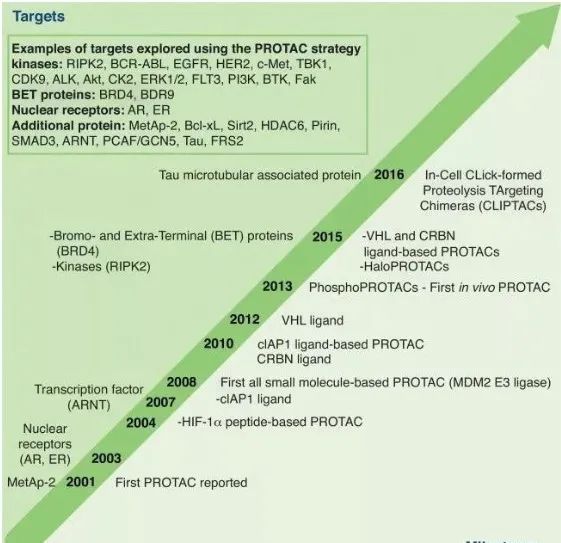
▲2001-2016 PROTAC的进化历程(图片来源:参考资料[3])
在2019年,PROTAC领域的先行者,Arvinas公司推动首款PROTAC药物ARV-110 进入了临床的研究,这是一款针对男性前列腺癌的药物。3个月之后,Arvinas的第二款PROTAC药物,针对女性乳腺癌的ARV-471也进入了临床1期研究。近日,Arvinas宣布这两款药物在临床早期中均取得了积极的结果,前景非常光明。
PROTAC的广阔前景
在全球疫情爆发的大背景下,新药研发产业机遇与挑战并存。
当前有几个因素严重制约产业发展,首当其冲的就是新药研发的经济和时间成本都非常高,这也就是我们经常说的“双十原则”:一款新药的诞生需要投入超过10亿美元的研发成本和10年的研发周期。技术不成熟,缺少结构新颖的化合物,同时化合物合成难度大,这些因素都是制约新药开发速度与效率的瓶颈。
PROTAC的出现,为小分子新药开发打开了一个广阔的新世界。首先,人体内有600多种泛素连接酶E3,目前PROTAC技术只用到了其中的几种,巨大的蓝海正在等待业界去探索。其次,PROTAC是一项非常新的技术,而正是由于这个技术出现的时间很短,目前只有为数不多的分子进入临床研究,比如前面提及的ARV-110和ARV-471,但尚未有产品真正获批。这是一个全新的赛道,生物医药产业的创新者和创业者有望在这个领域全新出发,目前很多公司正在加码对PROTAC的研发投入,每一个人都可能在下一个拐点来临之际实现弯道超车。
药明康德化学服务部依托20年的小分子合成经验积累,建立了专业的PROTAC平台,利用在PROTAC方面的经验和技术,为广大创新合作伙伴提供有力的技术支持,提供各种特殊结构PROTAC分子的定制合成,量级从毫克级研发到公斤级放大,并凭借高效、快捷的标准化试剂购买及定制化的合成服务,为合作伙伴降低开发壁垒,加速研发进程。
对PROTAC分子来说,除了分子设计与合成存在挑战,同样存在挑战的还有分离纯化。PROTAC分子往往有一些溶解性低、稳定性差、高极性的特征。药明康德以专业的团队专注于PROTAC分子的分析和纯化,迄今,已经分离过超过2000种不同的PROTAC分子,并针对手性和非手性PROTAC分子开发了200多种特定的分析方法。
随着蛋白降解疗法受到越来越多的关注,多家专注于蛋白降解疗法开发的新锐公司也获得了资本的青睐,例如Arvinas、Kymera Therapeutics、Nurix Therapeutics、C4 Therapeutics等公司。今年来,多家公司完成超过1亿美元不同轮次的融资,其中Kymera Therapeutics、Nurix Therapeutics、C4 Therapeutics三家公司更是先后登陆纳斯达克。我们期待不远的将来,在这个全新的赛道上,PROTAC分子能够不断涌现,有更多新药好药问世,为广大病患带去福音。

















