到现在可以捋一捋复必泰疫苗在中国内地的坎坷道路了。从2020年到2022年主要有以下几个关键节点,2020年11月,2021年4月,2021年6月-8月,2022年2月。本文不涉及政策问题。
2020年11月,复星医药开始BNT162b2临床试验(BNT162-06),从目前的信息来看,复星当时的想法是在2021年第一季度获得批准并开始接种,二期临床试验的主要终点是血清转化率和GMT(第二剂后1个月),次要终点也可以拿到约13个数据,印证的消息有复星预计在2021年1月启用位于浦东机场祝桥镇附近的超低温冷库。
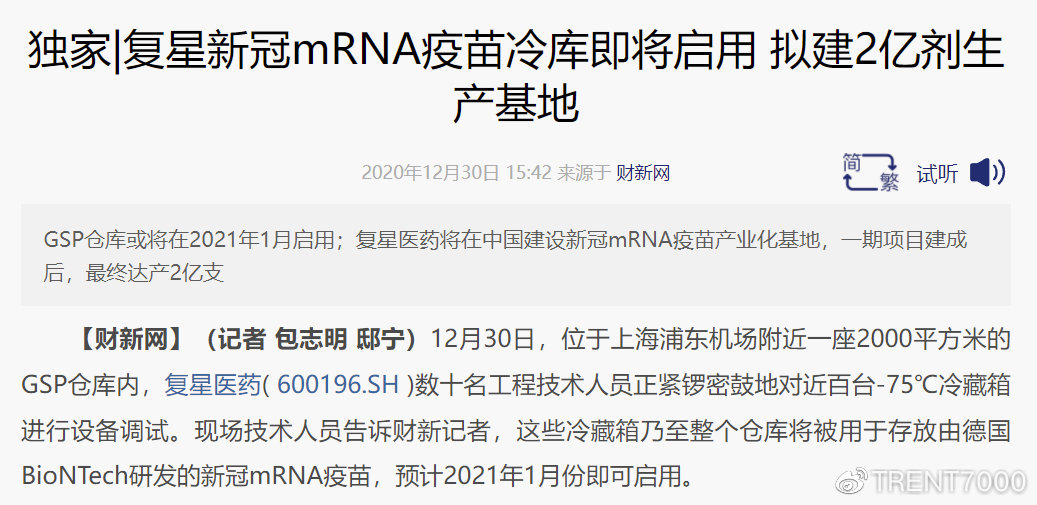
复星同部分外企及组织联系称预计3月前可以接种疫苗


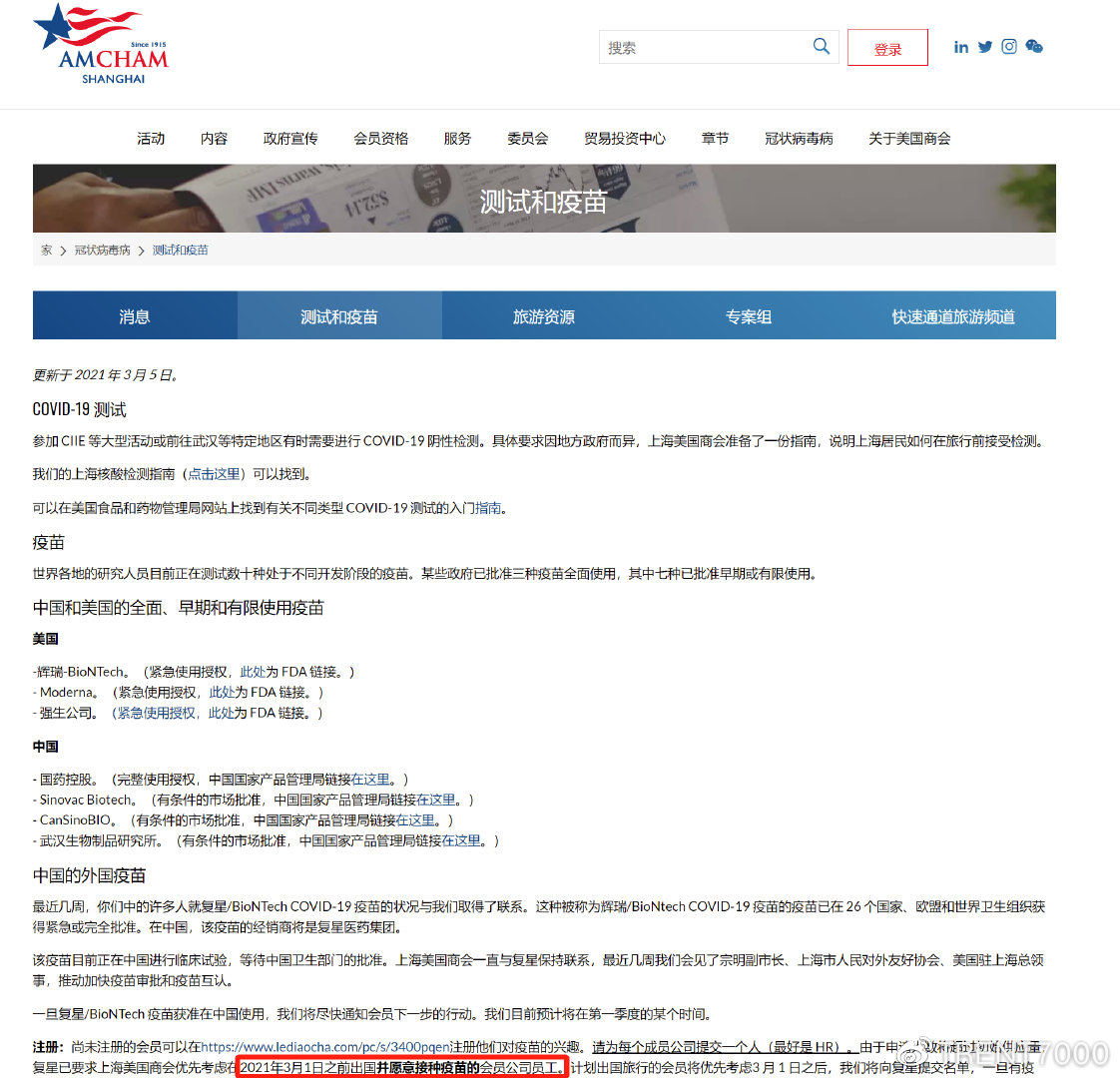
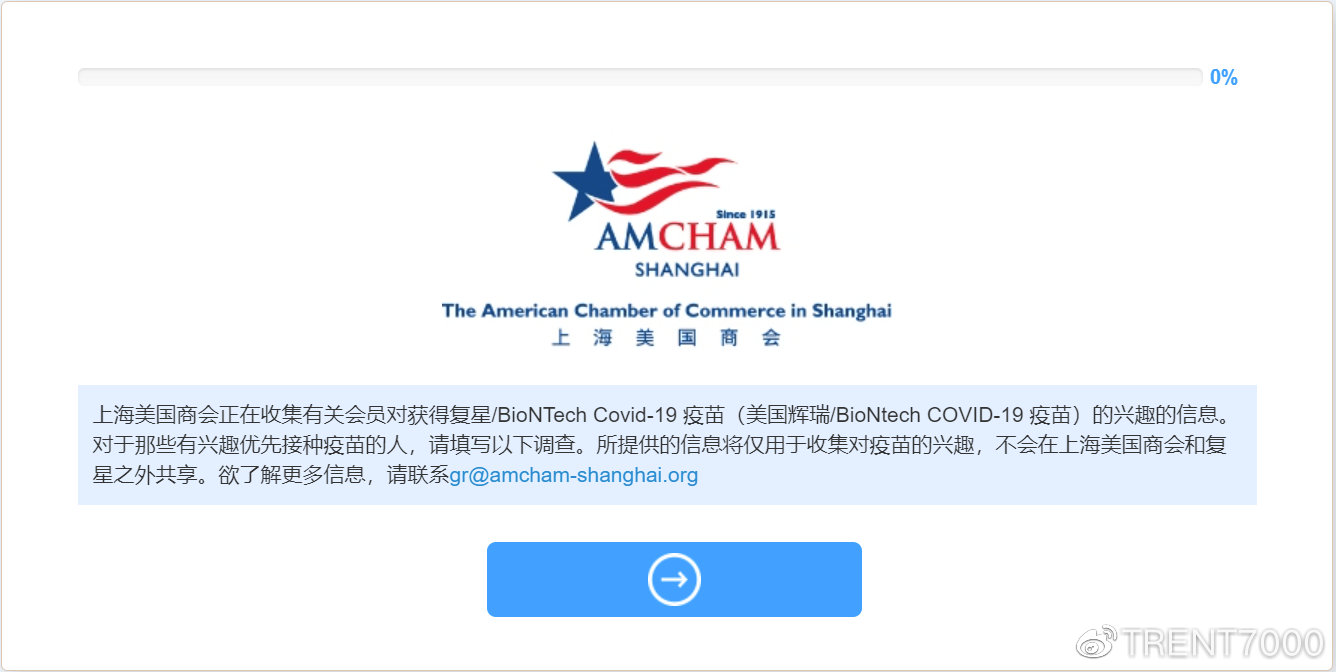

(AMCHAM,和睦家),并提供了意向登记表。
2021年4月,香港收到第一批简体中文标签的复必泰疫苗,这批包装和后期简体中文标签略有不同,主标签写的是多剂量瓶,每瓶稀释后含5剂,而后期的则是每瓶0.45mL,稀释后含6剂。

同期一份内地版复必泰说明书中规格写的是多剂小瓶包装,0.45mL每瓶。接种对象中写有中国18-85岁人群接种本品的II期临床研究尚在进行中。这说明当时复星是有意使用II期中期数据+国际III期数据申请EUA或BLA,但药监局没有批准,因此将第一批预先生产的简体中文标签疫苗转到了香港地区。

4月底-5月初复星举行了私立医院mRNA疫苗专讨会,复星的工作人员确定了不久后可以接种mRNA疫苗,当时复星分发的宣传手册中规格仍标注的是多剂量瓶(每瓶稀释后含有5剂,每剂0.3mL)。


2021年6月,上海凯茂生物获得上海市药监局行政许可,产品为新型罐装病毒mRNA疫苗(进口分包装)(注册申报阶段),其中受委托方名称以及地址与第一批送往台湾的包装上信息一致。

复星在贵阳举行论坛,来自江苏省疾控中心的工作人员介绍了复必泰疫苗的配送方法以及配置方法,这是内地版复必泰疫苗包装首次公布,包装上已预留批准文号位置。

大量私立医院开始接受复必泰疫苗接种预约,复星健康的工作人员也表示按照内部口径复必泰疫苗预计6月底7月初完成审批上市。去年12月的时候复星的人也表示他们在6月时已经基本提交了全部的数据给药监局。在这个阶段确实有很多迹象表明复必泰确实很快就可以上市并开始接种了。
2021年7月。吴以芳在股东大会上表示,国家药监局对mRNA新冠疫苗“复必泰”的审定工作已经基本完成,专家评审已经通过了,目前正在加紧进行行政审批阶段。在供货问题上,复星医药已经与BioNTech提前启动生产准备工作,复必泰疫苗一旦获批,就能第一时间供应到国内。2021年6月9日,新包装第一批(公开信息)简体中文标签复必泰出厂,批号1F032A,2021年7月15日,批号1G042A,2021年7月17日,批号1G043A,三批至少约270万剂。



2021年8月,复必泰没有如期上市,复星向药监局申请临床,受理号CXSL21WZ001,CXSL意味着国产新生物制品申请临床,WZ为2021年后药监局为新冠类药品新设置的独立号段,审批结论未知。
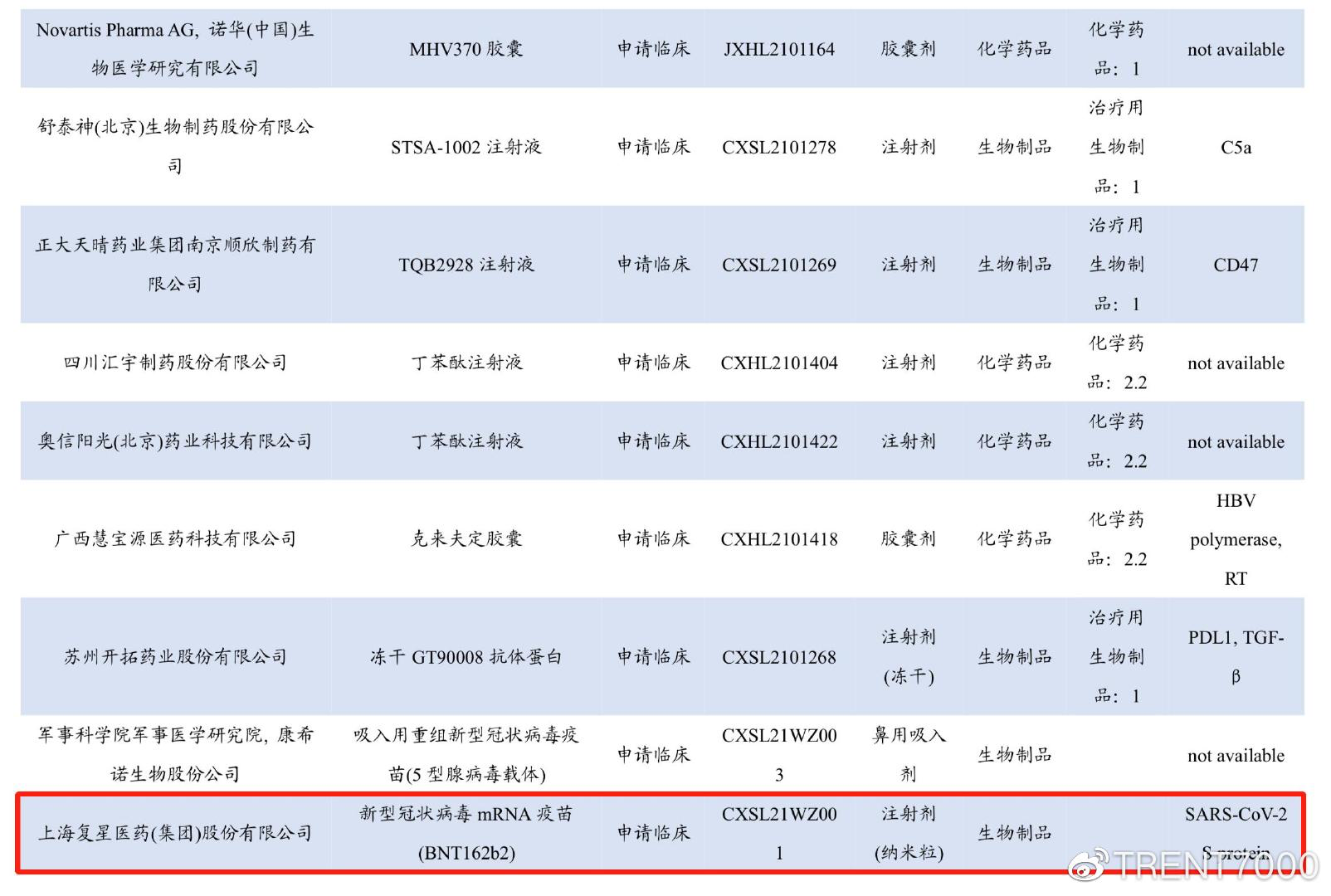
同期香港和台湾地区开始接收简体中文标签的复必泰疫苗,送往台湾的疫苗在卢森堡启运时可以看到有简体中文的宣传横幅(2月运往香港地区的横幅为繁体字和COMIRNATY),这意味着这批疫苗原本计划送往浦东机场,因未获批被迫送至桃园机场。

运往香港地区的疫苗

去年4月送往香港地区的疫苗的包装

运往台湾地区的疫苗
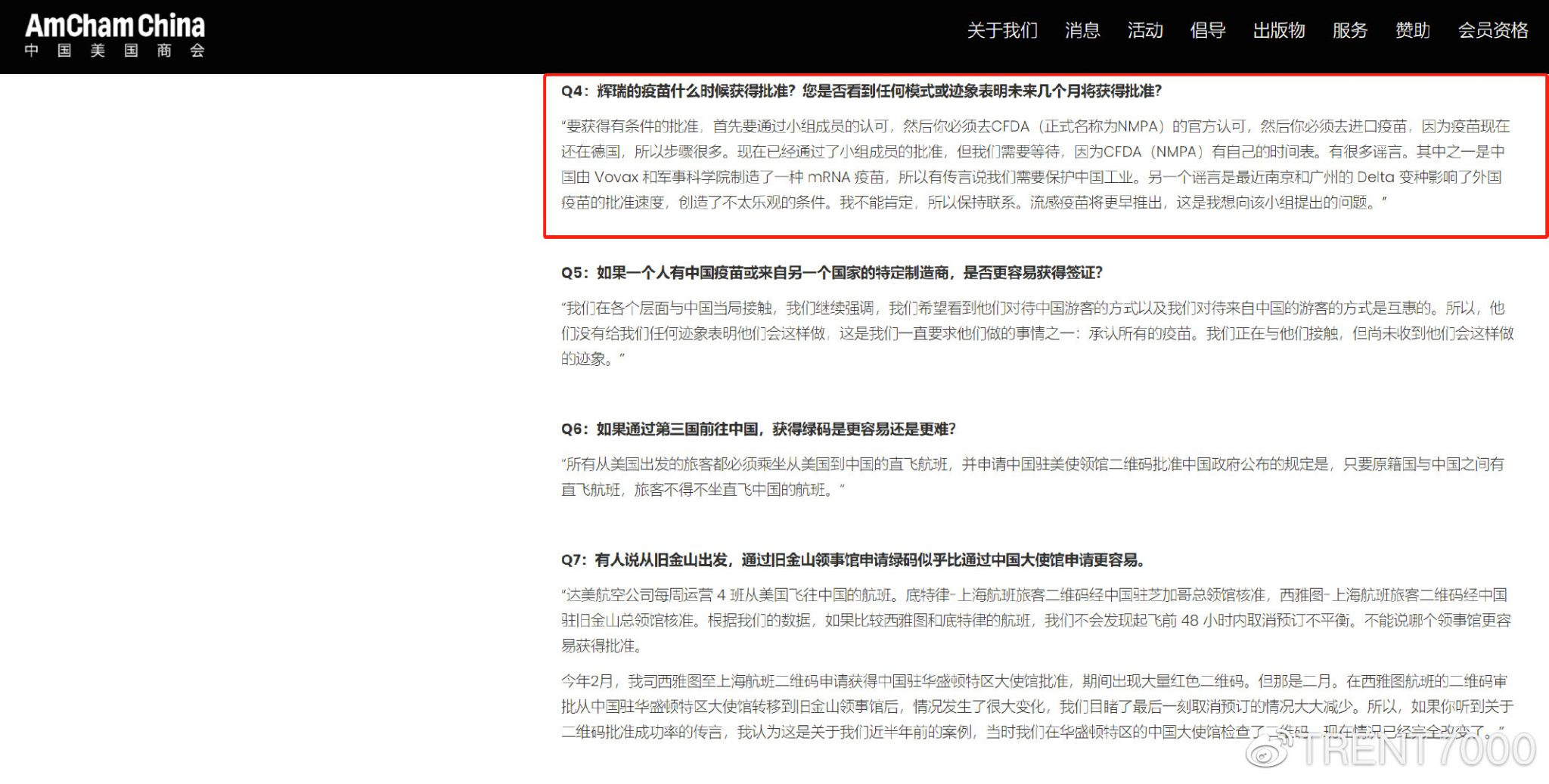
同期和睦家医院的药房主管在一次电话会议上发表了她的看法,她认为疫苗的延期可能和国产mRNA疫苗进度以及Delta变体扩散影响了批准程序。
2021年11月,香港继续接收带有简体中文标签的疫苗,同期土耳其也收到简体中文标签的疫苗。
2022年2月,复星在Clinical Trails更新的BNT162-06临床试验信息,预计完成时间从2021年12月变更为2022年4月30日,这意味着II期试验仍在进行中。

最后我想谈谈我的一些想法,吴以芳在6月和7月股东大会上的信息基本上是没问题的,BioNTech确实在那时就已经提前开始生产,如果不是药监局授意我想复星也不敢这样冒险提前生产这么大批量的疫苗却不能使用,由于各地区法规不同,疫苗转送涉及到比较复杂的法律问题。但问题就出在复星提交BLA申请后药监局一直没有正式受理复星医药的申请,没有给一个准确的答复,并且复星仍在滚动提交临床数据,截止到今天也不能查询到受理号。吴以芳说的专家审评基本完成,行政审批正在进行更像是PRE NDA阶段的专家沟通交流会,就像12月份复星的人也认为一旦正式受理就基本没什么问题。第二点我认为CDE为了谨慎起见可能需要让复星提交完整的II期实验的完整数据(第二剂后1年)而不是通过中期数据就申请上市,这可能是mRNA疫苗有潜在导致心肌炎等不良反应而做出的必要措施,可以理解,就像今天复星更新了II期试验的进展证明相关工作仍然在推进中。
以上内容不涉及政策因素,毕竟辉瑞的PAXLOVID获批是打破了多项纪录,比如国内外获批间隔时间最短,完全参考国际III期数据以及FDA EUA等。辉瑞的受理号是JXHS22WZ001,批准文号为HJ20220006,据传从申请到批准用时不超过10天,这也没地说理去。

















