本周《自然》贡献了一篇令人深思的论文,对,就是我们接下来要说的这篇。麻省波士顿儿童医院的科学家们发现, 新冠病毒竟然可以感染免疫细胞,而且并非是通过我们熟悉的ACE2受体,而是在抗体的“帮助”下通过Fcγ受体进入细胞[1]。
被感染的单核细胞和巨噬细胞释放的大量细胞因子,或许就是触发新冠肺炎重症患者大规模炎症反应的扳机;同时, 抗体在其中扮演的角色也提醒我们,目前正在研发的治疗性抗体有一定风险成为炎症的潜在帮凶。

大规模炎症可以说是新冠肺炎带来的一系列器官损伤的始作俑者,自疫情开始,科学家们就在探索到底是什么触发了炎症。
研究者们首先尝试着检查了新冠肺炎患者的血浆,发现有 约6%的单核细胞(monocytes)处于焦亡(pyroptosis)状态,这是一种与炎症有关的细胞死亡。一般死亡细胞很快就会被清除,因此同时观察到如此之多的死细胞,这绝对不正常。
相对健康人的血浆, 新冠患者血浆中所有焦亡相关的生物标志物水平都显著更高,而在患者内部,重症患者又尤为突出。
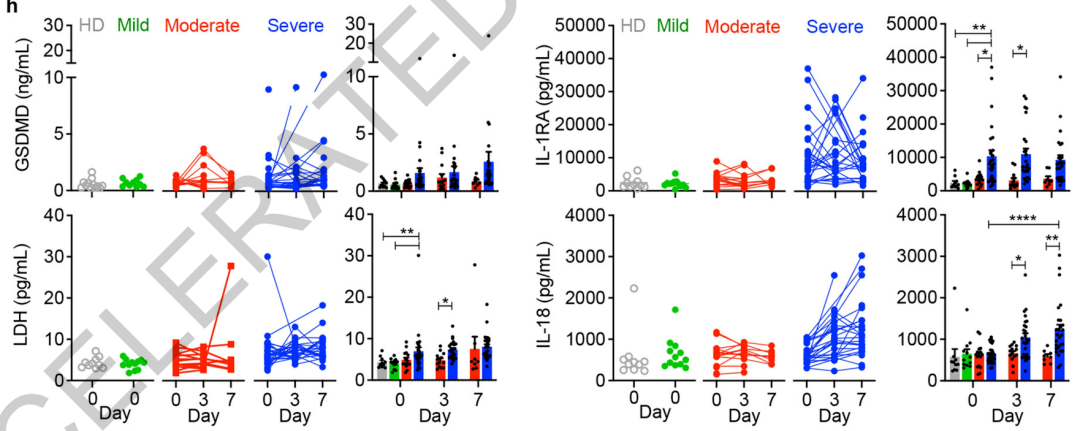
新冠患者的焦亡标志物和炎性细胞因子水平更高
重症患者相对轻症更高
这些数据表明, 焦亡导致的单核细胞死亡及后续的促炎细胞因子释放,很可能是预后不佳的一个原因。
此外,研究者们还发现了一个迷惑现象, 在许多单核细胞中存在新冠病毒核衣壳,而这些单核细胞毫无例外地都表达了一种表面受体CD16,也就是结合抗体的Fc受体家族的FcγRⅢa, 它主要参与抗体依赖的细胞吞噬作用(ADCP)。
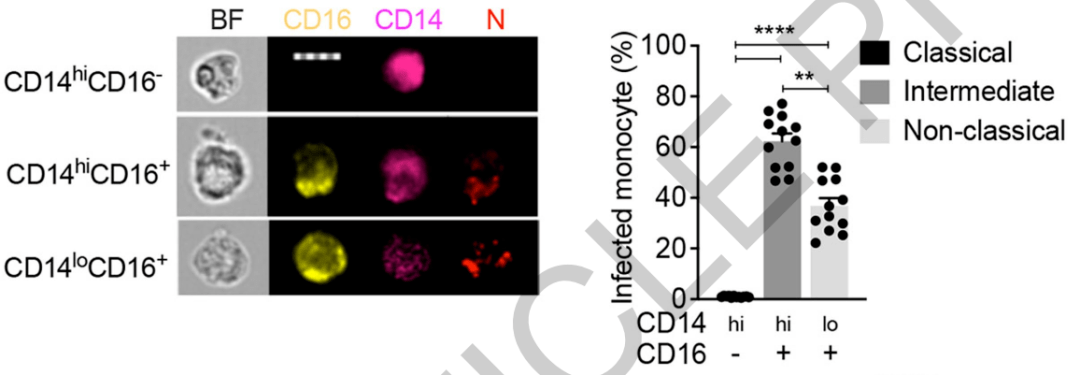
CD16与核衣壳染色(N)共定位
那么,到底是什么让单核细胞“发炎”乃至死于焦亡呢?
病原体感染是炎症的一大诱因, 此前也有为数不多的研究称单核细胞和巨噬细胞可以被新冠病毒感染,而且研究者们还在单核细胞中检测到了新冠病毒的“遗物”,这不由得让人猜测,单核细胞有可能被新冠病毒感染了。
但是最大的问题是, 新冠病毒进入细胞的大门ACE2,单核细胞是并不表达的。
研究人员也进行了进一步的确认,在单核细胞中也发现了病毒复制的迹象。总的来说,约10%的单核细胞中发现了病毒核衣壳或双链RNA,其中95%存在病毒复制; 几乎所有被感染的细胞都显示出了焦亡的标志物,而所有存在焦亡现象的细胞都是被感染的细胞。
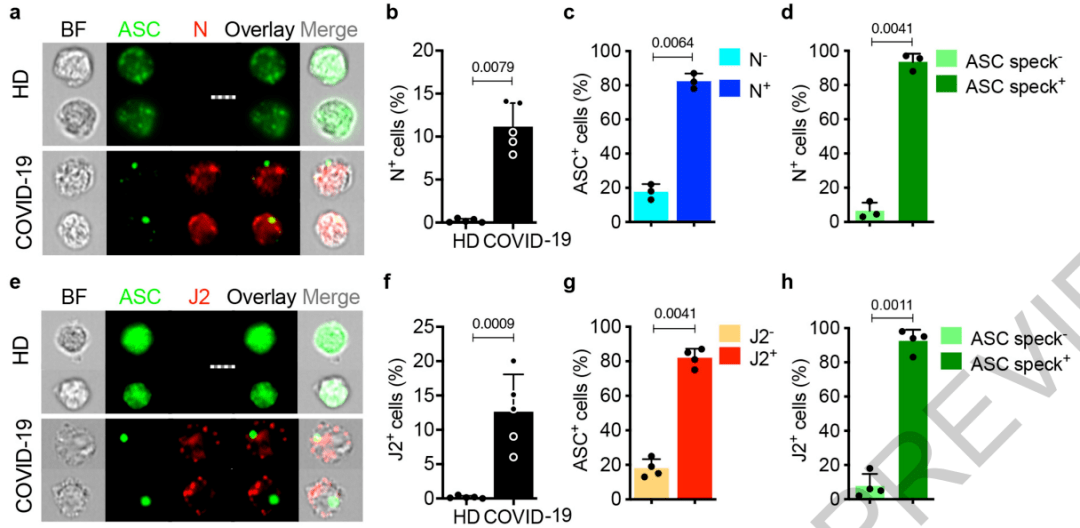
核衣壳(N)、焦亡标志物ASC斑、复制标志物J2
那么我们就可以肯定地说, 单核细胞的焦亡是被新冠病毒感染造成的。 这样的现象在新冠肺炎死者的肺部组织驻留巨噬细胞中也观察到了,而且是仅有巨噬细胞表现出焦亡和炎症激活,被感染的肺上皮细胞及内皮细胞并没有类似的现象。
同时,我们也不难判定, 在其中起到关键中介作用的就是CD16。其实在实验中,阻断CD64(FcγRⅠ)也能够阻止炎症和焦亡,但是由于CD16和CD64机制上有共同之处,研究者们认为起主要作用的还是CD16。
面对新冠病毒,连免疫细胞都失守了,这看似严重,不过倒也并不尽是坏事。 尽管实验中检测到单核细胞内新冠病毒已经开始了复制,但是实际上并没有产生具有可传染性的病毒,也就是说 单核细胞的炎症和焦亡实际上是抱住新冠病毒同归于尽,对于阻断病毒在体内的繁殖和扩散反而可能是好事。
最后一个问题是,到底哪些抗体会被新冠病毒利用呢?
有意思的是, 实验中来自新冠感染者自然产生的抗体会为新冠病毒侵染单核细胞大开方便之门,但是来自接种mRNA疫苗者的抗体就没有这样的作用。
从实验细节中我们可以窥见些许端倪:① 针对S蛋白的IgG可以介导新冠病毒感染,但是纵使疫苗接种者的抗RBD IgG水平是患者的二倍,也不能促进病毒进入细胞或复制;②急重症新冠患者体内的抗体Fc段会出现明显的非岩藻糖修饰(afucosylated),这有助于与CD16的结合[3], 低非岩藻糖修饰的IgG与来自健康人的IgG一样,都不会促进感染。
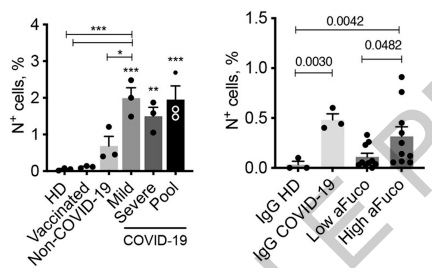
左:疫苗接种后产生的抗体不会促进感染
右:低非岩藻糖修饰抗体不会促进感染
可见是否会被病毒利用,还要看抗体的结构,那么不要大意地多考虑一步, 目前正在研发的各种治疗性抗体中,或许就有潜伏的危险分子——当然,这都要留给后续的实验去探索了。
这篇论文首次发现新冠病毒感染单核细胞由抗体介导,实验内容与近期发表在预印本上的另外一篇论文[4]也多有互相印证之处。值得庆幸的是,疫苗产生的抗体目前看来还是非常安全,大家一定都要去接种疫苗啊!

参考资料:
[3]Larsen, M. D. et al. Afucosylated IgG characterizes enveloped viral responses and correlates with COVID-19 severity. Science 371, eabc8378, https://doi.org/10.1126/science.abc8378(2021).
(代丝雨)

















