抗体-药物偶联物(ADC)由linker、payload、单克隆抗体(mAb)组成。它结合了高特异性靶向能力和强效杀伤作用的优势,实现了对癌细胞的精准高效杀灭,已成为抗癌药物研发的热点之一。自第一个 ADC 药物Mylotarg ®(gemtuzumab ozogamicin)于2000年获得FDA批准以来,截至2021 年 12 月全球共有 14 款 ADC 药物获批用于血液系统恶性肿瘤和实体瘤,此外,目前还有100多个ADC候选者处于临床试验的不同阶段。 日前,Nature 子刊signaltransduction and targeted therapy刊登了由华中科技大学同济医学院发表的一篇深度综述中,回顾了 ADCs 的历史和作用机制,并讨论了 ADCs 关键组成以及其对ADCs活性的影响机制。另外该综述还详细介绍了已批准的 ADC 药物和其他有希望获批(处于III 期临床)候选药物,并讨论了当前挑战和下一代ADC发展的未来前景。今天,微信公众号drug-conjugates团队将与读者分享这篇综述的精彩内容。

/01/ ADC 药物开发和批准的重要事件的时间表 早在 20 世纪初,Paul Ehrlich 就首先提出了“魔法子弹”的概念,并假设某些化合物可以直接进入细胞中某些所需的靶点,从而治愈疾病。从理论上讲,这些化合物应该能有效杀死癌细胞,但对正常细胞无害。 2000年,美国食品药品监督管理局(FDA)首次批准ADC药物Mylotarg® (gemtuzumab ozogamicin)用于成人急性髓系白血病(AML),标志着ADC靶向治疗癌症时代的开始。图1描绘了过去百年ADC药物从婴儿阶段到成熟发展阶段的标志性事件。随着靶点和适应症的不断扩大,ADC正在引领癌症靶向治疗的新时代,未来有望替代传统化疗药物。 图1 一个世纪ADC 药物开发和批准的重要时间表(图片来源:参考资料[1])
图1 一个世纪ADC 药物开发和批准的重要时间表(图片来源:参考资料[1])
1.ADC药物的构成 ADC由抗体、有效载荷和化学接头组成。理想的 ADC 药物在血液循环中保持稳定,精准到达治疗目标,并最终在目标附近(例如癌细胞)释放细胞毒性有效载荷。每个要素都会影响 ADC 的最终疗效和安全性,总体而言,ADC 开发需要考虑所有这些关键组成部分,包括靶点、抗体、细胞毒有效载荷、接头以及偶联方法的选择。 图2 ADC药物的结构和特性(图片来源:参考资料[1])
图2 ADC药物的结构和特性(图片来源:参考资料[1])
目标抗原 肿瘤细胞上表达的靶抗原是 ADC 药物识别肿瘤细胞的制导方向,它也决定了将细胞毒性有效载荷传递到癌细胞中的机制(例如,内吞作用)。因此,选择合适的靶抗原是ADC 的首要考虑因素。 首先,为了降低脱靶毒性,靶向抗原应仅表达或主要表达在肿瘤细胞中,而在正常组织中不表达或很少。例如,与正常细胞相比,某些类型肿瘤中 HER2的表达大约高出正常细胞 100 倍,这为 ado-trastuzumab emtansine、fam-trastuzumabderuxtecan 和 disitamab vedotin 的开发奠定了坚实的基础。 其次,靶抗原应该是非分泌的,因为在循环中分泌的抗原会导致ADC 结合到肿瘤部位之外,从而导致肿瘤靶向性降低和安全性问题。 第三,理想的目标抗原与相应的抗体结合后应该被内化,这样 ADC-抗原复合物就可以进入癌细胞,然后通过适当的细胞内运输途径和释放细胞毒性有效载荷。 目前获批ADC药物的靶抗原通常是癌细胞过表达的特异性蛋白,包括实体瘤中靶点HER2、Trop2、Nectin4和EGFR,以及血液恶性肿瘤靶点CD19、CD22、CD33、CD30、BCMA和CD79b 。在肿瘤学和免疫学基础研究的推动下,ADC 靶抗原的选择已逐渐从传统的肿瘤细胞抗原扩展到肿瘤微环境中的靶标(例如在基质和脉管系统)。临床前和临床研究新证据表明,新生血管系统、内皮下细胞外基质和肿瘤基质的成分可能是 ADC 药物开发的有价值的靶抗原。 图 3 ADC可用的肿瘤细胞和肿瘤微环境(脉管系统和基质)靶点(图片来源:参考资料[1])
图 3 ADC可用的肿瘤细胞和肿瘤微环境(脉管系统和基质)靶点(图片来源:参考资料[1])
抗体 肿瘤靶向抗体对于靶抗原和 ADC 之间的特异性结合至关重要。除了与靶抗原的高结合亲和力外,理想的抗体部分还应促进有效的内化,表现出低免疫原性并保持较长的血浆半衰期。 在 ADC 药物开发的早期阶段,主要使用小鼠来源的抗体,由于严重的免疫原性相关副作用,开发失败率高。随着重组技术的出现,鼠抗体大多被嵌合抗体和人源化抗体所取代。目前,ADC 越来越多地采用免疫原性显着降低的完全人源化抗体。在 14 种获批的 ADC 药物中,只有 Brentuximab vedotin 使用了嵌合抗体。 作为血清中免疫球蛋白的主要成分,目前ADC药物中使用的抗体多为免疫球蛋白G(IgG)抗体,包括IgG1、IgG2、IgG3和IgG4四种亚型。IgG1 是 ADC 常用的亚型,因为 IgG1 在血清中含量最多。 抗体-抗原复合物的内化,效率主要取决于抗体与肿瘤细胞表面抗原之间的结合亲和力,较高的亲和力通常会导致更快的内化。但是高亲和力的抗体可能降低抗体对实体瘤的渗透。实体瘤的治疗比血液肿瘤更复杂,因为在实体瘤中存在结合位点屏障(BSB), 抗体和抗原之间极高的亲和力会导致 ADC 在它们结合之后被困在血管附近外但较少渗透到远离血管的肿瘤细胞。因此,应优化抗原和抗体之间的合理亲和力,以平衡靶细胞的快速吸收和抗癌效力。 除了结合亲和力,另一个影响肿瘤穿透的因素是抗体的大小。IgG 抗体的大分子量(约 150 kDa),通常对穿透毛细血管和肿瘤组织中的基质存在较大的障碍。因此早期的 ADC药物主要针对血液系统恶性肿瘤。为了使 ADC 更好地治疗实体瘤,研究人员试图通过去除 FC 片段来使抗体小型化。微型化抗体不仅保留了高亲和力和特异性,而且更容易穿透血管进入实体瘤,从而大大提高了对实体瘤的杀伤效果。然而,也发现这种变化会导致半衰期的减少。因此,在设计具有小型化抗体的 ADC 时,应考虑各种因素。 图 4 癌症中的基质变化(图片来源:参考资料[2])
图 4 癌症中的基质变化(图片来源:参考资料[2])
Linker ADC 中的linker将抗体与细胞毒性药物连接起来。它对ADC 的稳定性、有效载荷释放曲线有非常大的影响,对于 ADC药物的最终疗效至关重要。理想的Linker不应诱导 ADC 聚集,并可防止有效载荷在血浆中的过早释放,并可癌细胞内有效释放。根据细胞中的代谢命运,大多数 ADC 药物中使用了两种类型的接头,包括可切割和不可切割的接头。 可裂解接头利用体循环和肿瘤细胞之间的环境差异,准确释放游离的细胞毒药物,可进一步分为化学裂解接头(腙键和二硫键)和酶裂解接头(葡糖苷酸键和肽键)。另一种对还原性谷胱甘肽(GSH)敏感的化学敏感的可切割接头。GSH 在细胞存活、细胞增殖和分化过程中对维持细胞内氧化还原平衡起着至关重要的作用。血液中 GSH 的浓度远低于癌细胞中的细胞内浓度。因此,这种类型的接头可以在血液系统中保持稳定,同时特异性地释放癌细胞中的活性有效载荷。 基于肽的接头对溶酶体蛋白酶敏感,并已用于许多 ADC。溶酶体蛋白酶,如组织蛋白酶 B,通常在癌细胞中过度表达,从而能够在肿瘤附近准确释放药物。另外由于血液中存在蛋白酶抑制剂,酶裂解的Linker在体循环中通常是稳定的,因此酶可裂解的linker降低了过早断裂带来的各种风险。在批准的 ADC 药物中,14 种药物中有 9 种使用基于肽的接头。 不可切割的接头(例如,硫醚或马来酰亚胺基己酰基)对体内常见的化学和酶环境是惰性的,由于血浆稳定性的提高不可切割接头的最大优势在于其较低的脱靶毒性,但有效载荷的旁观者效应受到影响。 有效载荷 有效载荷是在 ADC 内化到癌细胞后发挥细胞毒性的弹头。因为只有大约 2% 的 ADC 可以在静脉内给药后到达目标肿瘤部位,所以在 ADC 中有效载荷的化合物需要高毒性(IC 50在nM和pM范围内)。此外,这些化合物应在生理条件下保持稳定,并具有可与抗体共价结合的功能基团。目前,用于 ADC 的细胞毒性有效载荷主要包括强效微管蛋白抑制剂、DNA 损伤剂和免疫调节剂。

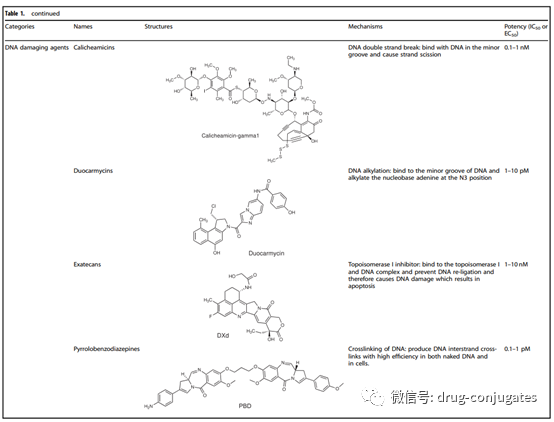
 图5 ADC 药物中使用的代表性小分子有效载荷(图片来源:参考资料[1])
图5 ADC 药物中使用的代表性小分子有效载荷(图片来源:参考资料[1])
偶联方式 除了选择抗体、接头和有效负载外,小分子部分(即接头加有效负载)与抗体连接的方法对于成功构建 ADC 也很重要。通常,抗体上赖氨酸和半胱氨酸残基的存在为偶联提供了可反应位点,早期的 ADC 药物通常通过赖氨酸或半胱氨酸残基的随机偶联。然而,抗体通常包含大约 80–90 个赖氨酸残基,其中 40 个赖氨酸残基通常是可发生反应。通过与赖氨酸残基的随机偶联,不同数量 DAR(0-8)的小分子毒素可能附着在抗体上,导致药物-抗体比(DAR)分布较宽。此外,由于赖氨酸残基分布在整个抗体轻链和重链中,抗体-抗原识别位点附近的偶联反应可能会降低 ADC 与靶标的结合。 基于半胱氨酸的反应提供了另一种偶联方式。通常,IgG1 抗体同时具有链间二硫键和链内二硫键。链间二硫键暴露在抗体的外部,很容易被还原以暴露游离的半胱氨酸残基,从而为连接子有效负载与抗体的偶联提供了可用的位点。由于结合位点的数量有限和硫醇基团的独特反应性,使用半胱氨酸作为连接位点有助于降低 ADC 的异质性。根据还原率的不同,与赖氨酸残基偶联的产品相比,DAR 为 2、4、6 和 8 的产品可能会产生更好的均质性。这是迄今为止商业产品中最常用的偶联方式。但值得注意的是,打开链间二硫键可能会破坏抗体的完整性。 赖氨酸和半胱氨酸残基的随机偶联可能会导致许多问题。这种偶联的稳定性有时不够,这会导致过早的有效载荷释放,从而导致脱靶毒性。此外,很难保证有效负载连接到抗体上的一致位点,增加了质量和均一DAR值控制的难度。为了减少 ADC 的异质性,目前已经在新的 ADC 中开发了几种位点特异性偶联策略。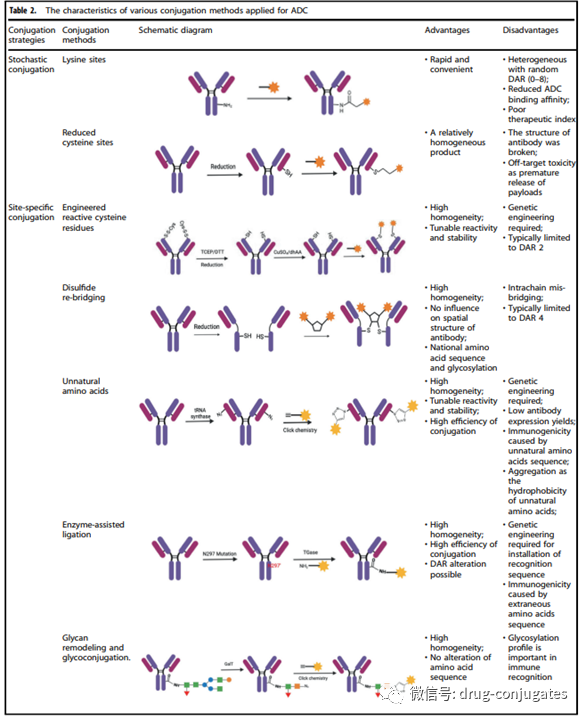 图6 ADC 的特异性偶联策略(图片来源:参考资料[1])
图6 ADC 的特异性偶联策略(图片来源:参考资料[1])
/02/ ADC的作用机制 ADC通过组合发挥“特异性”靶向作用和“高效”杀伤癌细胞的作用。这类药物就像精准制导的“生物导弹”,能够精准摧毁癌细胞,提高治疗窗口,减少脱靶副作用。 图 7 ADC杀死癌细胞的作用机制(图片来源:参考资料[1])
图 7 ADC杀死癌细胞的作用机制(图片来源:参考资料[1])
ADC的抗癌活性还涉及ADCC、ADCP和CDC的作用。一些 ADC 的抗体 Fab 片段可以结合病毒感染细胞或肿瘤细胞的抗原表位,而 FC 片段结合杀伤细胞(NK 细胞、巨噬细胞等)表面的 FCR,从而介导直接杀伤效果(图7左下图)。此外,ADC的抗体成分可以特异性结合癌细胞的表位抗原,抑制抗原受体的下游信号转导(图7右下)。
/03/ ADC的研究进展 从药物组成和技术特点来看,ADC药物可细分为三代。
 图 8 ADC药物开发的演变(图片来源:参考资料[1])
图 8 ADC药物开发的演变(图片来源:参考资料[1])
第一代 ADC 早期ADC主要由常规化疗药物通过不可切割的接头与小鼠来源的抗体偶联而成。这些 ADC 的效力并不优于游离的细胞毒性药物,并且具有很大的免疫原性。后来,更有效的细胞毒剂与人源化 mAb 的组合使用极大地提高了疗效和安全性,因此第一代 ADCs 获得了市场批准(包括 gemtuzumabozogamicin 和 inotuzumab ozogamicin)。在这两种产品中,使用了 IgG4 同种型的人源化 mAb,并通过酸不稳定接头与有效的细胞毒性加利车霉素偶联。然而,该系统也存在很大的缺陷;
1)Linker的不稳定性:例如身体其他部位可能出现酸性条件,也可以发现第一代ADC中的接头在体循环(pH 7.4,37°C)中缓慢水解,导致有毒有效载荷不受控制地释放和意想不到的脱靶毒性。
2)容易聚集:第一代使用的有效载荷是疏水性的,容易引起抗体聚集,导致出现一些缺陷,如半衰期短、清除速度快和免疫原性。
3)药物的异质性:第一代 ADC 的缀合基于通过赖氨酸和半胱氨酸残基的随机偶联,从而产生DAR 不同的高度异质混合物。因此,第一代 ADC 表现出次优的治疗窗口,需要进一步改进。
第二代 ADC 以Brentuximabvedotin 和 Ado-trastuzumab emtansine为代表的第二代 ADC 在优化 mAb 同种型、有效载荷以及linker后获批。这两种 ADC 特点:
1)使用IgG1 同种型 mAb,更适合具有小分子有效载荷和高癌细胞靶向能力的生物偶联。
2)毒性更高的有效载荷,提高了水溶性和偶联效率。可以将更多有效负载分子加载到每个 mAb 上,而不会诱导抗体聚集。
3)Linker的改进实现了更好的血浆稳定性和均匀的 DAR 分布。总体而言。 所有这三个要素的改进都会提高第二代 ADC 的临床疗效和安全性。然而,仍然存在许多未满足的需求,例如由于脱靶毒性导致的治疗窗口不足,以及在那些具有高 DAR 的 ADC 中的聚集或快速清除。当 DAR 超过 6 时,ADC 表现出高疏水性,并且由于体内清除速度更快而趋于降低 ADC 效力。在这种情况下还需要通过位点特异性偶联优化 DAR,以及不断优化 mAb、接头和有效负载。
第三代 ADC 第三代 ADC 以 polatuzumabvedotin、enfortumab vedotin、fam-trastuzumab deruxtecan 和后来批准的 ADC 为代表。
1)均一 DAR(2 或 4),具有一致 DAR 的 ADC 显示出更少的脱靶毒性和更好的药代动力学效率。
2)完全人源化抗体而不是嵌合抗体来降低免疫原性。 此外,正在开发抗原结合片段(Fab)以替代许多候选 ADC 中的完整 mAb,因为 Fab 在体循环中更稳定,并且可能更容易被癌细胞内化。此外,已经开发出更有效的有效载荷:如 PBD、微管溶素和具有新机制的免疫调节剂。尽管第三代中的Linker类型没有任何更新,但已经开发了一些新实体用于结合各种有效负载。为了避免对免疫系统的干扰,提高在血液循环中的保留时间,在第三代 ADC 中采用了更多的亲水性Linker组合,例如 PEG 化。亲水性Linker还可以用于平衡某些细胞毒性有效载荷(如 PBD)的高疏水性,具有疏水性有效载荷的 ADC 通常易于聚集。总的来说,第三代 ADC 具有更低的毒性和更高的抗癌活性以及更高的稳定性,使患者能够接受更好的抗癌治疗。
/04/ 当前的挑战和下一代 ADC 从已批准药物和开发中的候选药物可以看出,新一代 ADC 的特异性和细胞毒性比前几代产品越来越好。然而,在开发ADC 的过程中仍然存在许多挑战,包括药代动力学的复杂性、肿瘤靶向和有效载荷释放不足以及耐药性。
主要挑战 复杂的药代动力学特征 ADC 给药(主要通过静脉输注)后,三种主要形式可能存在于体循环中,即完整的 ADC、裸抗体和游离的有效载荷。在 ADC 的典型药代动力学特征中,偶联 ADC 和裸抗体的浓度随着 ADC 的内化和抗体清除而持续降低。影响抗体清除的因素包括单核吞噬细胞系统和Fc 受体(FcRn)介导的再循环。通过与内吞的ADC高亲和力结合,FcRn将ADC输出到细胞外区室进行循环利用。因此,与传统的小分子药物相比,包括偶联 ADC 和裸抗体在内的抗体通常具有更长的半衰期。 游离的细胞毒有效载荷主要在肝脏代谢,通过肾脏(尿液)或粪便排出体外,这可能会导致肝肾功能损害。所有这些因素,再加上患者间高度差异,很难建立 PK 和 PD 模型来描述 ADC 的临床特征并协助设计新的 ADC。
不可避免的副作用 在批准的 14 种 ADC 中,最常见的严重副作用(3 级或更高)是血液毒性,包括中性粒细胞减少、血小板减少、白细胞减少和贫血。血液毒性以及肝毒性和胃肠道反应可能与细胞毒性有效载荷过早释放到血液循环中有关。这与主要影响那些快速增殖的健康细胞的常规化疗药物一致。此外,ADC的抗体部分诱导的免疫反应可能引起继发性损伤,导致肾毒性。根据最近的临床观察,ADC 治疗期间潜在的肺毒性作用(如 ILD)应引起注意,特别是在抗 HER2 ADC 中。在 T-DM1 和 DS-8201 的临床试验中,有几例死亡病例被报道与 ILD 相关。然而,ILD 的详细作用机制仍不清楚。有人猜测,可能的原因之一可能与健康肺细胞中 ADC 的不良摄取和 ADC 释放的游离有效载荷有关。由于血流量最丰富且在肺中的停留时间最长,ADC 的不良摄取和血液中的游离有效载荷最常发生在肺中以诱发 ILD。此,需要对下一代ADC进行相应的优化,以尽量减少副作用。用药期间应密切监测不良反应,预防或给予支持治疗。
肿瘤靶向和有效载荷释放 与传统的细胞毒药物相比,ADC的分子量要大得多,药物穿透肿瘤的效率有限。目前的研究表明,只有一小部分输入到患者的 ADC 可以到达肿瘤细胞,因此在设计 ADC 时需要考虑有效载荷的效力。
耐药性 ADC 开发的另一个挑战是耐药性。酪氨酸激酶抑制剂(TKI)的耐药性通常涉及药物靶点的逃逸突变。然而,ADC 的耐药机制尚未得到充分表征。ADC耐药性更加复杂和多样化。目前的证据表明,肿瘤可以通过多种方式产生ADC 耐药,例如降低抗原表达水平、改变细胞内转运途径、对有效载荷的耐药性。
下一代 ADC
1)使用ADC靶向突变蛋白 目前的研究表明,ADC内化和细胞内转运途径对ADC的细胞毒活性具有关键影响。与野生型蛋白相比,突变蛋白通常具有更高的泛素化水平,更容易被内化和降解。这意味着如果使用ADC靶向突变蛋白,可能会带来显着的临床反应。可以想象,靶向携带致癌突变蛋白(如某些EGFR突变体)的ADC可以最大限度地提高治疗的肿瘤特异性,达到选择性TKI的水平。
2)双表位或双靶点ADC 双特异性抗体技术的进步为ADC创新带来了更多可能。这些 ADC 设计可以改善抗体内化并提高肿瘤特异性。目前正在开发的疗法一直在探索这些可能性。针对同一抗原上不同位点的双特异性 ADC 可以改善受体聚集并导致靶点快速内化。此外,双特异性 ADC 双靶向 HER2 和 LAMP-3 在临床前实验中显示出更好的溶酶体聚集和负载传递。
3)使用两种不同的有效载荷组合 使用两种不同的细胞毒剂作为有效载荷的双有效载荷 ADC 以降低耐药性。通过准确控制两种药物的比例,将两种协同有效载荷递送到癌细胞中,可以实现更有效的疗效。并且随着两种不同机制的有效载荷的应用,耐药性的发生率将显着降低。例如,设计了一种同时包含 MMAE 和 MMAF 的均一的抗 HER2 ADC,并在异种移植小鼠模型中发挥了比共同施用相应的单有效载荷 ADC 更显着的抗肿瘤活性。
4)多肽偶联物(PDC) 另一种ADC发展策略是摒弃mAb的传统结构,选择将payload与分子量较小的多肽片段偶联。这些策略的主要目的是降低 ADC 的分子量,从而提高穿透效率和有效载荷向肿瘤组织的传递。例如,PEN-221是一种 ADC,由 DM-1 与靶向生长抑素受体 2 的多肽链结合而成。其分子量仅为 2 kDa,远低于传统 ADC 中 150 kDa 的 IgG 分子。目前此类 ADC 面临的技术挑战是它们可能会在血浆中快速清除。然而,如果我们能够克服这一障碍,它在治疗难以接近的肿瘤方面具有潜力,包括血管神经支配不良的肿瘤和中枢神经系统肿瘤。
5)开发非内化ADC 传统上,为了将有效载荷输送到癌细胞中,ADC 需要高内化能力的 mAb。然而,由于抗原屏障,mAb 通常难以扩散到实体瘤块中。因此,可以为 ADC 开发非内化抗体。它是基于有效载荷在肿瘤微环境中在还原条件下直接释放到细胞外,然后扩散到癌细胞内部导致细胞死亡的原理。 最后,在有效载荷选择方面仍有很多创新机会。
/05/ 结语 目前已成功开发出多种 ADC 疗法,使数以万计的癌症患者受益。14 种 ADC 药物的获批以及多种 ADC优异的临床表现也引起了人们对该领域的更多关注,这对于这个相对年轻但高度复杂的领域来说非常重要。随着这些领域研究人员的不断努力,不难想象未来的ADC将在癌症靶向治疗中展现出更多的惊喜。 参考文献 [1]Antibody drug conjugate:the “biological missile” for targeted cancer therapy. Signal Transduction and Targeted Therapy(2022)7:93 [2] The matrix in cancer. Nat Rev Cancer. 2021 Feb 15. doi:10.1038/s41568-020-00329-7. Epub ahead of print. PMID:33589810.

















