T-DXd获得FDA加速的获批上市,是基于DESTINY-Lung02 II期试验的卓越数据。在52名HER2+,不可切除和/或转移性NSCLC患者中, ORR 高达58%。
HER3
HER3是HER2异源二聚化和激活PI3K/AKT信号通路的重要分子。HER3在各种实体瘤中都有表达,包括83%的NSCLC。鉴于HER3在NSCLC中的高表达及其在介导EGFR酪氨酸激酶抑制物(TKI)耐药中的潜在作用,HER3成为了NSCLC中一个有吸引力的ADC靶点。
Patritumab deruxtecan(HER3-DXd)由HER3单抗Patritumab也是通过的可切割四肽连接物连接到DXd上,DAR为8 。
HER3-DXd在一项I期研究中进行了评估,这些患者包括在TKI和化疗进展后激活EGFR突变的晚期NSCLC患者(队列1),以及在抗PD(L)1免疫检查点阻断后没有激活EGFR的患者(队列2)。在队列1中,81名患者入选,不考虑HER3的表达,并将HER3-DXd的剂量从3.2 mg/kg增加到6.4 mg/kg q3w。在这一人群中,47%的患者经历了≥G3 TRAE,其中以血小板减少(26%)、中性粒细胞减少(15%)和疲劳(10%)最为普遍。4例(5%)患者因治疗而发生ILD,其中仅1例为G3;选择5.6 mg/kg作为推荐扩张剂量(RDE)。在RDE治疗的57名患者的疗效明显。ORR为39%,mDOR为6.9个月,mPFS为8.2个月。抗肿瘤药效在具有一系列EGFR耐药机制的患者中均观察到,包括EGFR C797S突变、MET扩增、HER2突变、BRAF融合和PIK3CA突变。所有可评估的患者都有HER3的表达,有反应的患者的HER3表达得分中位数高于疾病进展的患者。基于这些发现,HER3-DXd于2021年12月被FDA授予突破性疗法认定。
TROP2
TROP2是一种糖蛋白跨膜钙信号转导蛋白,在包括肺癌在内的多种上皮性肿瘤中均有表达。在NSCLC中,TROP2在肺腺癌和肺鳞癌中的表达分别为100%和92%,其中TROP2蛋白的高表达分别为64%和75%。目前多个以trop-2为靶点的ADC正在进行临床试验。
Sacituzumab govitecan(SG)是一种由人源化的抗TROP2单抗Sacituzumab通过酸可切割连接子连接到拓扑异构酶-I抑制剂SN-38上的ADC药物, DAR为7.6。
第一个探索SG安全性和有效性的临床试验是I/II期剂量递增和扩展IMMU-132-01 basket试验。这项研究包括495名患者,没有对TROP2的表达进行选择,在21天周期的第1天和第8天,治疗剂量从8到18 mg/kg不等。在该队列中,59.6%的患者出现≥G3 TRAE,其中以中性粒细胞减少症(42.4%)、贫血(10.3%)、腹泻(7.9%)、乏力(6.3%)和发热中性粒细胞减少症(5.2%)最为常见。根据这些数据,选择10 mg/kg剂量进行剂量扩展。
在SCLC队列(n=62)中,患者在21天周期的第1天和第8天分别接受8、10、12或18 mg/kg SG治疗。ORR为17.7%,mPFS为3.7个月,mDOR为5.7个月,OS为7.1个月。在NSCLC队列中,54名患者在21天周期的第1天和第8天分别接受8、10或12 mg/kg的SG治疗。ORR为16.7%,mPFS为4.4个月,mDOR为6.0个月,OS为7.3个月。鳞癌和腺癌均有反应。92%的患者在IHC染色上有中等或高度的TROP2表达,这排除了将其作为预测生物标记物的实用性。基于这些数据,III期EVOKE-01试验正在评估SG 10 mg/kg与多西紫杉醇75 mg/m2在抗PD(L)-1免疫治疗和以铂为基础的化疗后用于晚期EGFR/ALK野生型NSCLC患者的疗效。
- Datopotamab Deruxtecan(Dato‑DXd)
Datopotamab deruxtecan(Dato-DXd)是由与DXd偶联的TROP2单抗Datopotamab偶联组成的ADC,DAR为4。
Dato-DXd的I期TROPION-PanTumor01试验的138名患者的初步结果显示,安全性可接受,45%的患者出现≥G3 TEAE,其中呼吸困难(4%)、疲劳(3%)、口腔炎(3%)和贫血(3%)最常见。在85名可评估疗效的患者中,ORR为27%;疗效与TROP2的表达无关。
在这项研究的NSCLC扩展队列中,180名晚期NSCLC患者每3周接受4、6或8 mg/kg的Dato-DXd治疗。ORR为24%,不同剂量的ORR相似。3个剂量的mPFS分别为4.3、8.2和5.4个月。接受8 mg/kg剂量治疗的患者中有35%出现与药物相关的≥G3 TEAE,而接受4 mg/kg和6 mg/kg剂量治疗的患者分别为14%和16%。在不同的剂量水平上,最常见的≥G3 TEAE包括口腔炎、恶心、疲劳、粘膜炎症和贫血。与药物有关的ILD发生率为10.6%(19/180),其中以8 mg/kg时最多(12/19),为G1/2(14/19),但有3例患者死于药物相关性ILD。Dato-DXd也显示出在驱动突变NSCLC患者的治疗潜力。在TROPION-PanTumor01中具有驱动突变的34名患者中,观察到ORR为35%,mDOR为9.5个月。Dato-DXd正在TROPION-Lung01试验中进行评估晚期NSCLC患者的疗效。患者被随机分为6 mg/kg Dato-DXd或75 mg/m2多西紫杉醇治疗。在III期TROPION-Lung08试验中,Dato-DXd还在PD-L1高表达(TPS≥50%)NSCLC的一线环境中接受评估,随机分为Dato-DXd加pembrolizumab或pembrolizumab单独治疗。
CEACAM5
癌胚抗原相关细胞黏附分子(CEACAMs)是一类细胞表面糖蛋白家族。CEACAM5在几种肿瘤类型中有选择性地表达,包括肺癌。
Tusamitamab ravtansine(TUSA)是一种CEACAM5抗体通过 可切割SPDB连接子与DM4偶联的ADC药物, DAR为3.8。
I期临床评估了TUSA在CEACAM5表达或可能表达CEACAM5的实体肿瘤患者的治疗研究,剂量为每两周从5到150 mg/m2不等。为两个NSCLC扩展队列选择的最大耐受量为100 mg/m2:(1)64例晚期非鳞状NSCLC患者,IHC≥2+以及≥50%的细胞高表达CEACAM5;(2)28例非鳞状NSCLC患者,IHC≥2+以及 1-49%的细胞中等表达CEACAM5。ORR在“高表达”组中的数值更高,为20.3%,而在“中表达”组中为7.1%,高表达组的mDOR为5.6个月。92例患者≥G3 TEAE率为51.1%,其中可逆性角膜病变/角膜炎(10.9%)、呼吸困难(10.9%)和乏力(4.3%)最为常见。基于优异的数据,CARMEN-LC03 III期试验招募了治疗难治的晚期非鳞状NSCLC患者,这些患者IHC≥2+以及≥50%的细胞高表达CEACAM5,随机接受TUSA 100 mg/m2每2周一次治疗或多西紫杉醇75 mg/m2每3周一次治疗。
MET
在NSCLC中,已观察到间充质向上皮转化(MET)基因的一系列变化,包括激活突变(METex 14)、基因扩增和蛋白过表达。
- Telistuzumab Vedotin(Teliso-V)
Teliso-V是一种由cMET单抗ABT-700与MMAE通过可切割的vc连接子偶联而成的ADC药物,DAR为3.1。临床前证据显示,肿瘤细胞表面c-Met表达分子的阈值水平>100,000是诱导肿瘤细胞杀伤的必要条件;正常组织中c-Met表达水平较低。
Teliso-V的首次人体临床研究在过表达c-MET(IHC H-score≥150)的NSCLC患者中进行。治疗耐受性良好,推荐的II期剂量为1.9 mg/kg q2w和2.7 mg/kg q3w。基于这些优异的数据,NSCLC的剂量扩展队列继续招募c-MET+( H-Score≥150)或含有MET扩增/外显子14跳跃突变的患者。在113名患者评估中,44%的患者发生≥G3 TEAE,其中肺炎(5.3%)和低钠血症(4.4%)最为常见。G≥3贫血、呼吸困难、乏力、GGT升高、周围神经病变和肺炎各占2.7%。在疗效方面,非鳞状NSCLC患者的结果最有效,其ORR为35.1%(13/37),mDOR为6.9个月。在非鳞状NSCLC和c-Met高表达c-MET(3 + IHC ≥ 50% 细胞)患者中,ORR值为53.8%(7/13)。基于这些优异的数据,Teliso-V于2022年被FDA批准用于c-MET高表达的晚期EGFR野生型NSCLC患者的突破性治疗。
在EGFR突变阳性和鳞状NSCLC队列中,疗效较为一般,ORR分别为13.3%(4/30)和14.3%(3/21),研究提前终止。Teliso-V也在EGFR突变的NSCLC患者中和厄洛替尼一起进行评估。在一项Ib期单一研究中,29名治疗难治性EGFR突变的NSCLC和c-Met+(IHC H-Score≥150)、METex 14跳跃或MET扩增的患者接受TelisV 2.7 mg/kg q3w加厄洛替尼150 mg/每天的治疗。ORR为34.5%,反应主要在c-MET高表达的患者中。在16名cMET H-Score为≥225的患者中,观察到ORR为50%。III期试验正在评估Teliso-V在698名晚期、难治、EGFR野生型、c-MET过表达的NSCLC患者中的疗效。
小编小结
技术进步使ADC作为一类有效的实体肿瘤抗癌药物获得重生,包括肺癌。虽然多种ADC药物有希望被批准用于NSCLC患者治疗,但依然存在许多挑战,如药物的最佳排序、新的组合策略以及对ILD等独特毒性的管理。但不管如何,ADC药物的前途是光明的,未来更多ADC的突破将会进一步改善NSCLC的治疗局面,大大提高NSCLC患者的生存益处。
参考文献
1.Antibody–Drug Conjugates in Non‑Small Cell Lung Cancer:Emergence
of a Novel Therapeutic Class.
2.Antibody-drug conjugates for cancer treatment.
【相关讯息】NEJM:ADC药物治疗非小细胞肺癌临床试验,效果显著
大约 3% 的非小细胞肺癌(NSCLC)具有 HER2 基因突变,携带 HER2 基因突变的非小细胞肺癌在从不吸烟的人群中比有吸烟史的人群中更常见,通常预后较差,并且经常发生脑转移。
尽管 HER2 靶向治疗改变了乳腺癌和胃癌患者的治疗方式,但 HER2 靶向治疗尚未被批准用于非小细胞肺癌患者。因此,此类患者通常采用标准化学疗法或免疫疗法进行治疗,然而效果却不尽如人意。此外,该人群中只有27%的患者对免疫检查点抑制剂有客观反应,大部分患者反应不佳。
曲妥珠单抗-德鲁替康(DS-8201)是一种抗体偶联药物(ADC),由人源化抗 HER2 单克隆抗体(Trastuzumab)、可裂解四肽基连接剂和细胞毒性拓扑异构酶I抑制剂(DXd)组成,该抑制剂可阻止癌细胞复制 DNA,从而导致癌细胞死亡。
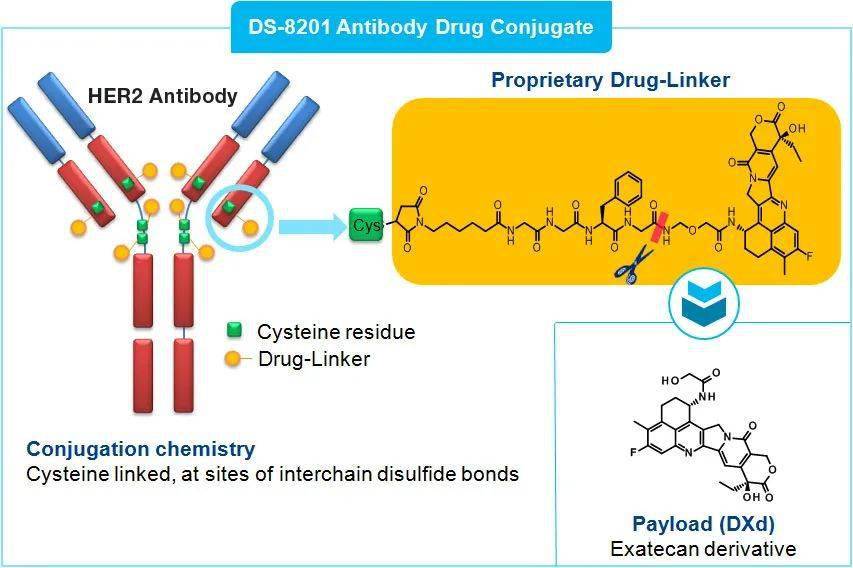
曲妥珠单抗-德鲁替康(DS-8201)结构
曲妥珠单抗-德鲁替康已被批准用于治疗 HER2 阳性转移性乳腺癌和胃癌患者。那么该ADC药物是否对 HER2 突变的非小细胞肺癌同样有效呢?
2021年9月18日,美国 Dana-Farber 癌症研究所的研究人员在国际四大医学期刊之首的《新英格兰医学期刊》(NEJM)上发表了题为:Trastuzumab Deruxtecan in HER2-Mutant Non–Small-Cell Lung Cancer 的研究论文。
在这项针对晚期 HER2 突变型非小细胞肺癌患者的多中心国际试验中,曲妥珠单抗-德鲁替康治疗显示出了高反应率,并延长了患者的生存期,仅有2%的患者发生致命事件。
不过,有20%的患者发生了间质性肺病,因此需要仔细的安全监测和管理。总之,该研究为ADC药物在此类肺癌患者中的持久抗癌活性提供了直接证据。

2018年5月30日至2020年7月21日期间,研究团队招募了91例 HER2 突变型非小细胞肺癌患者,并让他们接受曲妥珠单抗-德鲁替康治疗。在91名患者中,一名患者(1%)完全缓解,49名患者(54%)部分缓解,绝大多数患者(92%)的肿瘤缩小。在基线检查时的33例中枢神经系统转移患者中,14例曾接受过脑部放疗,19例未接受过放疗。在这些患者中,分别有8名和10名患者有部分缓解。
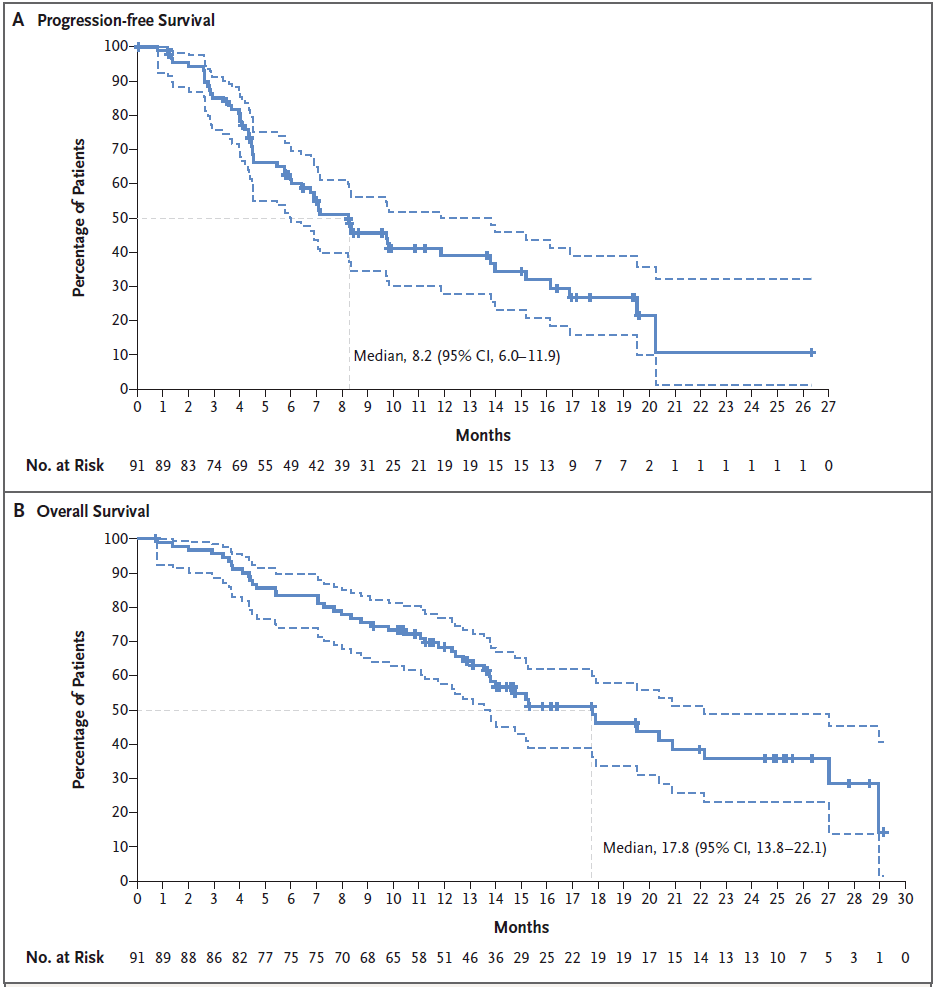
共有47名患者(52%)死亡,91位患者的中位缓解期为9.3个月,中位无进展生存期为8.2个月,中位总生存期为17.8个月。在基线检查时的33例中枢神经系统转移患者中,中位无进展生存期为7.1个月,中位总生存期为13.8个月。
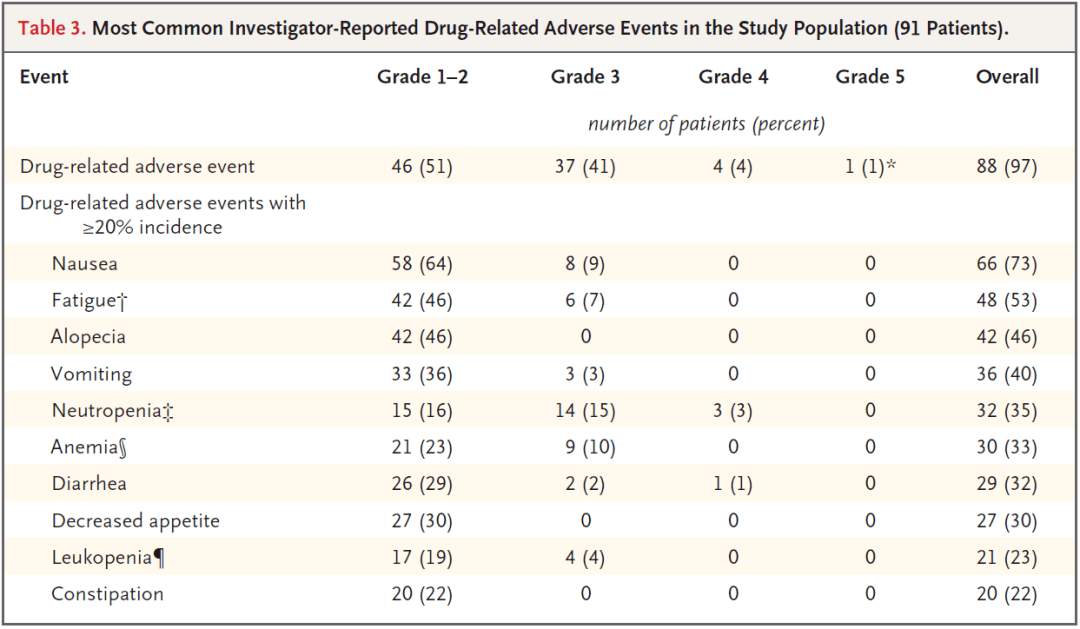
88名患者(97%)至少发生一个不良事件,研究团队报告这些事件与曲妥珠单抗-德鲁替康有关。47%的患者发生过轻度不良事件如胃肠道出血、食欲下降和脱发,18名患者(20%)发生过严重不良事件如间质性肺病,2名患者出现过致命不良事件。作为治疗的结果,24 名患者出现了间质性肺病或肺瘢痕。由于这个问题,研究团队停止了对 16 名患者的治疗并中断了对 8 名患者的治疗,出现这种情况的患者接受了类固醇治疗。
综上所述,这些数据表明,非小细胞肺癌中的 HER2 突变可以作为治疗靶点,曲妥珠单抗-德鲁替康在91例 HER2 突变型非小细胞肺癌患者中显示出持久的抗癌活性:55%的患者出现了经证实的客观疗效,中位疗效持续时间为9.3个月,中位无进展生存期为8.2个月,中位总生存期为17.8个月。这些结果支持使用曲妥珠单抗治疗 HER2 突变的非小细胞肺癌患者。
该临床试验由第一三共和阿斯利康资助。曲妥珠单抗-德鲁替康(DS-8201)由日本药企第一三共开发,阿斯利康于2019年3月与第一三共签订了高达69亿美元的全球合作开发和商业化协议。
论文链接:
https://www.nejm.org/doi/10.1056/NEJMoa2112431

















