之前的一些观察性研究提示,炎症调节因子 Regnase-1是间接克服T细胞耗竭影响的潜在靶点,当T细胞被破坏时,Regnase-1会引起过度炎症,使它们恢复以产生抗肿瘤反应。研究团队猜测,如果同时抑制另一个相关但独立的炎症调节因子 Roquin-1可能进一步促进抗肿瘤反应 。
研究团队对两种处于临床阶段的T细胞疗法进行了研究,分别是靶向间皮素的CAR-T细胞疗法mesCAR-T和靶向人食管鳞状上皮癌抗原1的TCR-T疗法NYESO TCR-T。使用 CRISPR-Cas9基因编辑技术分别敲除它们的Regnase-1或Roquin-1,或同时敲除Regnase-1和Roquin-1。
CRISPR-Cas9基因编辑后的工程T细胞被扩增并输入实体瘤小鼠模型中,研究团队观察到,敲除 Regnase-1或Roquin-1均能提高CAR-T或TCR-T的效果。而双重敲除能够将工程T细胞扩增至少10倍,还增加了抗肿瘤免疫活性和工程T细胞寿命,带来最佳抗肿瘤效果,其中Regnase-1是主要贡献者。
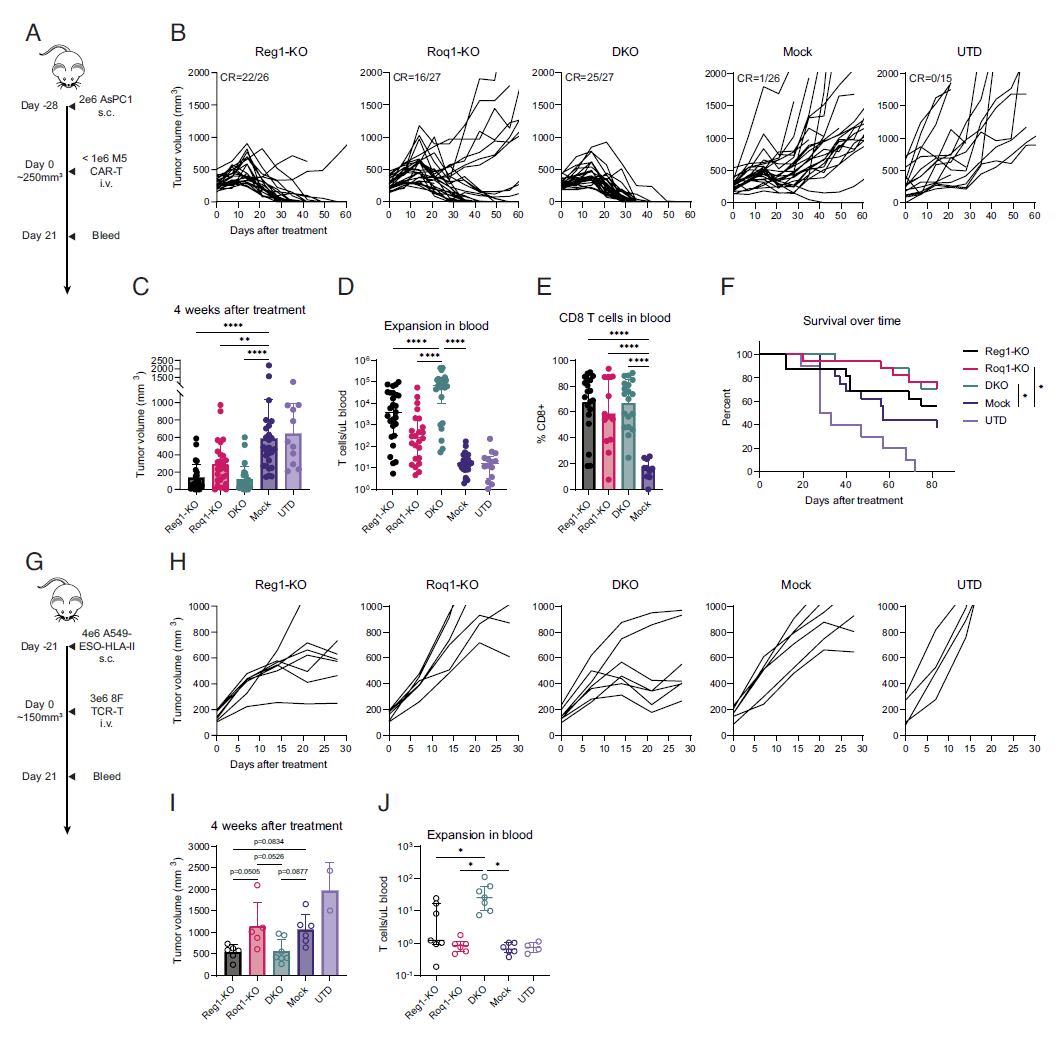
在实体瘤治疗中,经常看到CAR-T细胞的扩增受限,如果能够让这些T细胞更有效,并大量帮助大门大量扩张,就能让T细胞疗法更好地攻击实体瘤。
该论文的第一作者 David Mai 博士表示,这两个炎症调节因子中的每一个都涉及限制T细胞炎症反应,而将它们同时抑制比单独抑制一个产生更强大的抗癌效果, 在之前研究的基础上,这项研究让我们越来越接近在实体瘤环境中有前景的CAR-T细胞治疗策略。

















