目前已批准上市的CAR-T细胞疗法严重依赖于病毒转导,是一种时间和成本密集型的策略,且可能存在安全问题。相比之下,将体外转录的CAR-mRNA直接转移到T细胞中是CAR-T细胞工程的一种更为简便、安全的策略。电穿孔(EP)目前在临床试验中被用作生成CAR-T细胞的mRNA递送方法,但实际获得的工程化T细胞仅表现出不尽如人意的抗肿瘤活性。
我们曾在“改善基于mRNA的CAR-T生产工艺,“在体CAR”是否是康庄大道?”一文中提到与诺华(Novartis)的CAR-T疗法研发生产合作多年的弗劳恩霍夫细胞治疗和免疫学研究所(IZI)。IZI研究所在Scientific Reports上发表过题为“How to improve mRNA-based CAR-T cell generation and functionality? A lab-scale comparison(如何改善基于mRNA的CAR-T细胞生成和功能?实验室规模的比较)”[1]的文章。该文章通过对常规生产参数的调整,提出了两种优化方案,为mRNA制备CAR-T的工艺流程升级提供参考。该团队经比较实验后认为,基于LNP的转染方式可能是更好的可放大的制备工艺,将显著优于传统电穿孔的方式。
基于这一假设,2023年10月18日,IZI研究所联合Precision NanoSystems在Cell子刊Molecular Therapy - Methods & Clinical Development上在线发表了题为“Lipid Nanoparticles(LNPs)outperform Electroporation in mRNA-based CAR T cell Engineering”的研究论文,进一步对比了常规电穿孔(EP)与LNP在制备CAR-T工程细胞中的不同表现。与EP-CAR-T细胞相比,基于LNP的转染方式在体外增加了T细胞的活性,延长了CAR的表达时间,且增殖速度更为平缓,显著增强了CAR-T细胞的持久疗效。

来源:参考资料[2]
对比EP与LNP的mRNA转染
研究人员从CAR表达量、mRNA表达时间、CAR-T细胞功能性三个方面进行了对比实验,表征两种转染方法的差异。
为获得最优化的EP条件以和LNP方法进行比较,研究人员使用了不同的电穿孔设备,手动调整包括脉冲电压、精度等影响细胞通透性的参数,结果显示,在1600V,10ms,3脉冲条件下的电穿孔可获得最大细胞活性和较高的基因表达水平的CAR-T细胞。
LNP封装CAR-mRNA采用了商业GenVoy-ILMTM T细胞试剂盒。该T细胞试剂盒在基于mRNA的CAR-T细胞工程中比两种临床批准的LNPs的脂质成分更有效,对细胞活性的影响更小。需要添加载脂蛋白E4(ApoE4)才能使LNP成功转染T细胞,并观察到CAR的表达。该试剂盒条件下获得的LNP包封率约为96.8%,直径约为78.3 nm,多分散系数(PDI)约为0.201。6µg CAR-mRNA每106个T细胞作为LNP转染T细胞的最佳剂量,可维持高CAR表达和细胞活性。
转染后CAR-T细胞功能对比
本研究中使用了抗f(ab’)2-AlexaFluor647试剂孵育细胞,作为CAR表达强度指标,检测细胞表面的CAR表达。
在电穿孔组中,转染后6h即达到表达峰值,观察到有92%的T细胞表面有高强度CAR表达,表明电穿孔实现了快速有效的mRNA转染。但中位荧光强度(MFI)在1天后就显著降低,此后表达CAR的细胞比例快速下降,在第3天时低于10%(图1A)。
相较之下,LNP转染的细胞,其最大中位荧光强度(即最大CAR表达强度)显著低于EP转染。LNP转染1天后CAR表达才达到峰值,检测到84%的细胞表达CAR。这一结果表明,LNP转染后mRNA的表达较EP的更慢。然而,总RNA提取和qPCR分析显示,LNP转染的细胞内CAR-mRNA水平较EP转染的更高(图1C)。此外,转染2天后,LNP转染的细胞CAR表达量持续高于EP转染,直到6天后表达CAR的细胞比例才低于10%。
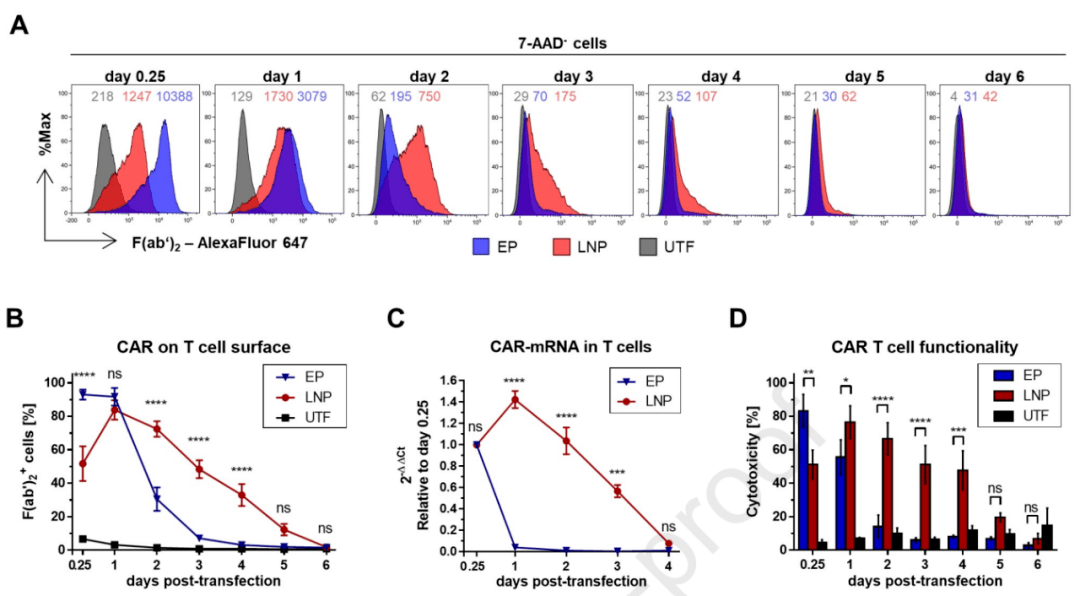
图1. 转染后CAR-T细胞功能对比
研究人员分析,这些结果可能是由两个原因导致的:
1)转染后部分mRNA仍被包覆在LNP中,未能及时表达CAR蛋白;
2)尽管EP可一次性转染大量mRNA,但快速的翻译导致了大量mRNA降解。
LNP转染的T细胞治疗活性与转染后CAR的表达时间一样较EP转染延长了3天。此外,LNP转染的T细胞针对表达CD123的KG-1细胞毒性下降也更为缓慢。尽管EP转染T细胞的细胞毒性在6h后就达到最大值83%,而LNP转染T细胞在1天后才达到最大值且为76%,低于EP,但具备细胞毒性的EP转染T细胞的在第3天就已经不足10%(图1D)。
因此,LNP转染的T细胞中,CAR-mRNA的表达时间将更长,且转染的CAR-mRNA水平更高,针对表达CD123的KG-1细胞的细胞毒性将更为持久。
转染后T细胞表型、活性和脱靶毒性对比
研究人员通过测量T细胞表面标记物来检测转然后T细胞的表型,包括T细胞亚型(CD3,CD4,CD8),激活(CD25)和衰竭(LAG-3)。结果显示,CD3表达和CD8+细胞毒性T细胞在两种转染方式中均未受到影响,CD4+辅助T细胞有略微下降,而CD4+CD8+T细胞则在两者中均显著增加,证明转染后CD4+辅助T细胞向CD4+CD8+T细胞的转变。同时,CAR-T细胞表面CD25表达的增加也证明转染后T细胞大量转变为激活表型。然而,EP转染的T细胞中LAG-3表达较LNP转染的更高,略微增加了T细胞的衰竭(图2A)。
对比可得出,EP或LNP转染在对T细胞的表型、激活和衰竭上无显著差异。
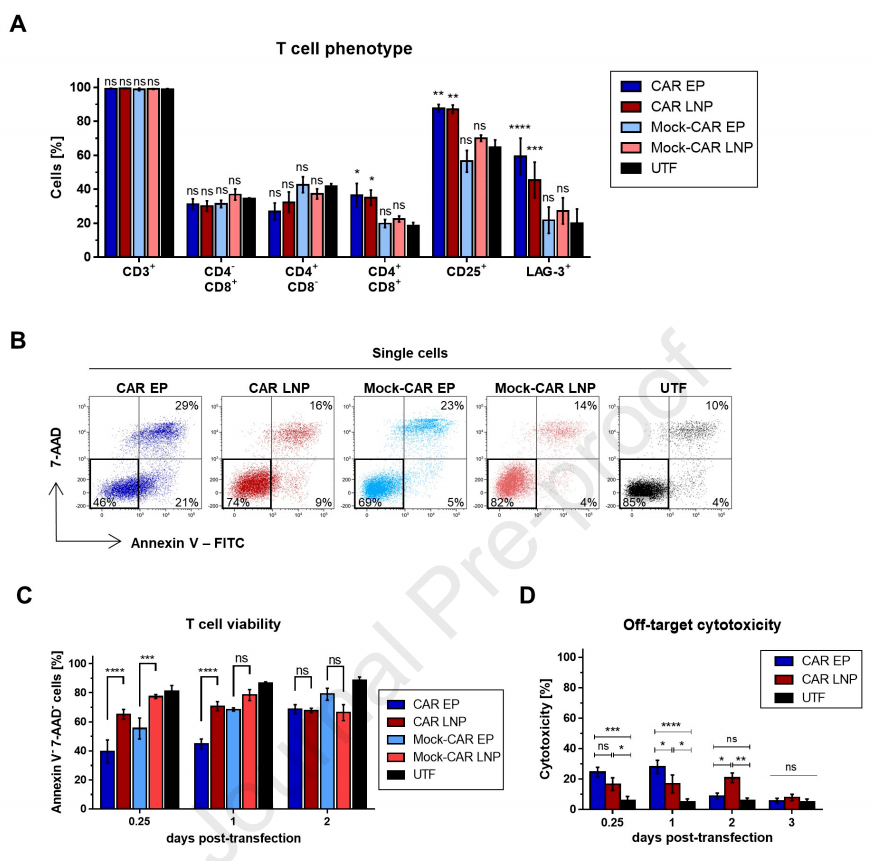
图2. 转染后T细胞表型、活性和脱靶毒性对比
通过对膜联蛋白(Annexin)V和7-AAD的双阴性分析,可以检测转染后T细胞的活性,细胞凋亡时Annexin V为阳性,细胞死亡时两者均为阳性(图2B)。根据图2C显示,EP-CAR-T细胞在0.25天(6h)时的细胞活性显著低于LNP-CAR-T(40% EP:65% LNP),且在1天后差距更大(46% EP:72% LNP)。这一结果表明,EP转染较LNP更容易降低T细胞活性,损耗细胞。
作为对照的Mock-CAR T组显示出较所有转染组更好的T细胞存活率,表明CAR细胞内激活域的强直信号(Tonic signaling)将对T细胞活性产生负面影响。由于强制信号可能导致非特异性毒性,研究人员测试了转染后CAR-T细胞对CD123阴性K562是否也会表现细胞毒性(图2D)。可以观察到,相较于未转染的T细胞,转染后CAR-T细胞具有较高的细胞毒性。
然而,对比转染1天后的细胞毒性,EP-CAR-T对K-562细胞的毒性明显强于LNP-CAR-T。转染第3天后,两者的非特异性细胞毒性均下降到与未转染T细胞一样的水平。该结果证明,mRNA工程化CAR-T细胞对非靶细胞具有短暂影响,但LNP方法在转染1天后相较于EP更为安全。
在此基础上,研究人员进一步测试了CAR-T细胞在靶细胞和非靶细胞分别或共同存在时的特性(图3)。由于CAR-T细胞识别靶细胞时的抗原依赖性增殖会影响CAR的表达动力学,研究人员设置了包含KG-1和K-562或分别只含单种细胞的试验组,对比CAR表达和CAR-T细胞的增殖差异。
两组CAR-T在转染1天后具有相似表达量,然而研究人员观察到,LNP-CAR-T的CAR表达在KG-1细胞中的后3天内和在K-562细胞中的后2天内均比EP-CAR-T有更显著的提高,表明LNP-CAR-T具有更持久的CAR表达(图3A, B)。与之相对的,两组CAR-T在KG-1和K-562中的细胞增殖都显示增加,证明T细胞的抗原依赖性增殖可能是由CAR介导的T细胞活化诱导的(图3C, D)。
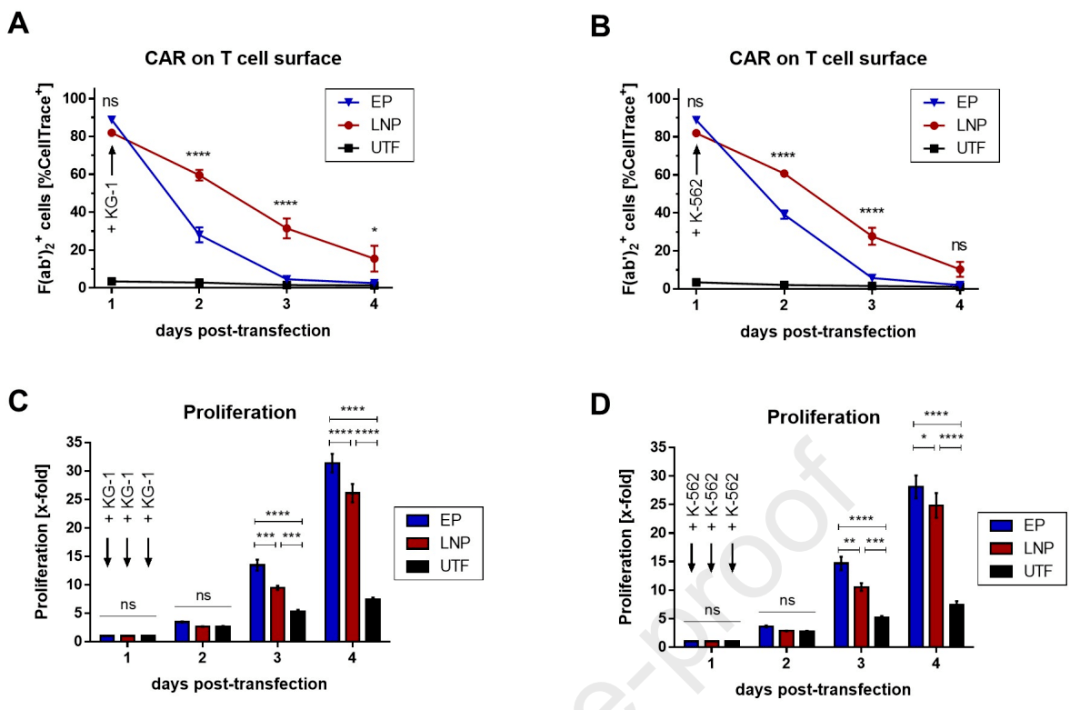
图3. CAR表达和CAR-T细胞增殖的差异
总结
本研究使用了相同的CAR构象、mRNA设计、mRNA数量、细胞计数、转染时间和T细胞扩展条件头对头比较了基于mRNA的电穿孔转染以及LNP转染两种方式的实际效用。LNP转染方式相较之下在延长CAR表达,降低T细胞毒性,延缓T细胞增殖减少细胞衰竭上具有更好的效益。
此外,LNP-mRNA的可制造性和可扩展性更具备成本和时间效益。作为一个灵活的平台,LNP-mRNA不需要改变制造过程和LNP配方,仅需改变序列设计即可筛选、生成不同的CAR-T细胞,为临床提供了方便、及时的生产制备途径。
参考资料
[1]Nadine Auw, Robert Serfling, Reni Kitte et al. How to improve mRNA-based CAR-T cell generation and functionality? A lab-scale comparison, 05 April 2023, PREPRINT(Version 1)available at Research Square. doi:10.21203/rs.3.rs-2719850/v1.
[2]https://www.cell.com/molecular-therapy-family/methods/fulltext/S2329-0501(23)00178-X#%20

















