
人类基因组中的许多内源性基因编码逆转录病毒样蛋白,这些蛋白是从古老的逆转录元件驯化而来的。副肿瘤Ma抗原(PNMA)家族成员编码一个gag样衣壳结构域,但它们作为衣壳组装和细胞间运输的能力仍未被描述。
2024年3月4日,博德研究所张锋团队在PNAS在线发表题为“Human paraneoplastic antigen Ma2(PNMA2)forms icosahedral capsids that can be engineered for mRNA delivery”的研究论文,该研究系统地探索了人类PNMA蛋白,发现人类细胞分泌了许多PNMA。
该研究确定PNMA2有效地形成二十面体衣壳,但不自然地包裹核酸。该研究解析了PNMA2的冷冻电镜(cryo-EM)结构,并利用该结构设计了具有RNA包装能力的工程PNMA2(ePNMA2)颗粒。重组纯化的ePNMA2蛋白将mRNA分子包装到二十面体衣壳中,并可以作为哺乳动物细胞系的递送载体,这表明了工程内源性衣壳作为核酸治疗递送方式的潜力。

基于RNA的疗法,包括基于mRNA的疫苗,具有广泛应用于各种疾病背景的潜力。为了实现这一潜力,我们需要一套能够有效包装和安全地将治疗性RNA货物运送到特定组织的运载工具。已经开发了几种递送方式,包括非病毒方法,如脂质纳米颗粒(LNPs),已成功用于递送寡核苷酸和mRNA治疗药物,以及病毒载体,如腺相关病毒(AAV)。然而,由于货物大小限制、免疫原性、难以实现组织特异性靶向和可扩展生产等因素,这些方法的广泛适用性受到限制。
来自人类基因组的自然递送系统可能为新的工程基因转移方式提供基础,可以解决这些限制。最近的研究发现,人类基因组中存在多种内源性gag样基因,它们类似于逆转录病毒结构蛋白,因此可能被设计用于基因转移。其中一些基因,包括Arc和Peg10,已经被驯化,并在正常哺乳动物生理中发挥重要作用。先前的研究也表明,ARC和PEG10 gag样蛋白具有形成衣壳结构的能力,可以包装它们的同源mRNA。为了扩展这种天然能力,PEG10最近被设计成可编程地包装并将外源性货物mRNA递送到人类细胞中,证明了这些内源性逆转录转座子衍生蛋白作为一种新的核酸递送方式的潜力。
为了进一步探索内源性gag样蛋白用于治疗性RNA递送的潜力,研究人员试图系统地表征副肿瘤Ma抗原(PNMA)蛋白家族。它在人类中含有超过12种蛋白质,最初是由于一些PNMAs编码副肿瘤神经系统疾病患者的自身抗原而被发现的。尽管一些PNMA家族成员先前已报道在细胞凋亡中起作用,但大多数仍然缺乏特征。然而,一些PNMA,包括小鼠PNMA2,已经被证明可以形成衣壳结构,这表明它们可能适合作为递送载体。
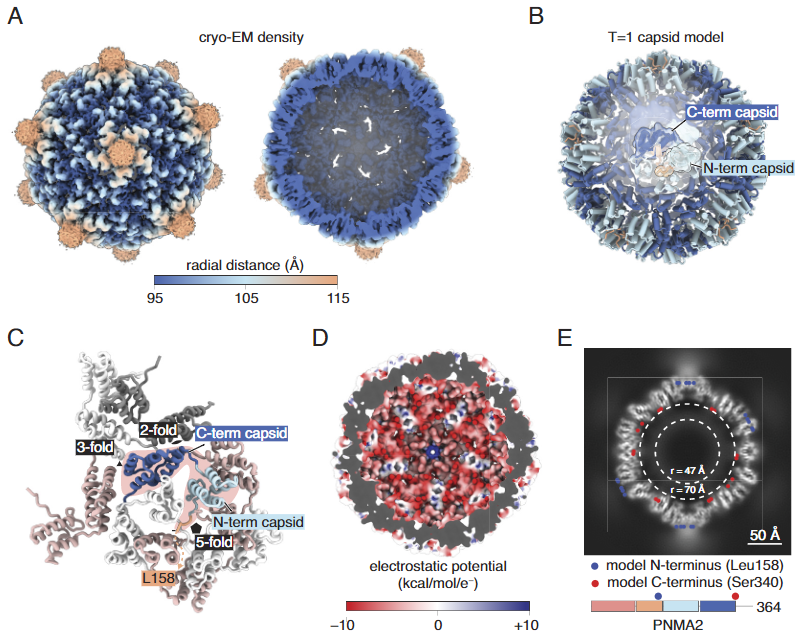
人PNMA2 capsi的冷冻电镜结构(来源:PNAS )
该研究探索了人类PNMA蛋白形成衣壳和包装RNA的潜力。该研究发现PNMA2作为二十面体衣壳从人细胞中大量分泌,并且可以在体外自组装重组蛋白。利用冷冻电镜(cryo-EM)分析PNMA2蛋白衣壳的结构,并利用结构引导工程对PNMA2蛋白衣壳进行了修饰以包装mRNA。该研究发现这些工程化的PNMA2衣壳可以功能性地将mRNA递送到受体细胞中,证明了作为一种治疗性mRNA递送载体的前景。除了PNMA2,该研究发现其他PNMA家族成员也能够形成病毒样衣壳,这表明它们也可能适合于递送,并提高了这些蛋白参与细胞间通讯的可能性。
参考资料
https://www.pnas.org/doi/10.1073/pnas.2307812120

















