“我为什么没有尾巴呢?”注视着小狗肆意摇摆的尾巴,孩童时的夏波不禁发出这一声灵魂拷问。转眼间,曾经的“好奇少年”已经成长为一名遗传生物学家,一次意外的尾骨受伤让他重拾对“尾巴”的思考。经过5年的探索,这一次他终于有了答案。

夏波。图源哈佛大学
近日,美国哈佛大学、Broad研究所基因调控观测站的华人研究员夏波以第一作者兼通讯作者的身份,在Nature上发表了题为“On the genetic basis of tail-loss evolution in humans and apes”的封面论文。这也是科学家第一次从遗传学角度揭示尾巴丢失的进化机制。

论文和封面截图。图源Nature
宿命相逢,好奇驱使
时间推回至2019年夏天,夏波正在美国纽约大学医学院攻读博士学位。那时,他已经发表了几篇很不错的文章,包括1篇Cell的封面论文。这意味着,他随时可以毕业。
然而,一次外出期间,在出租车上给后上车的乘客让座时,夏波不慎挫伤了尾骨软组织。这次意外的受伤重燃了他对“人类为什么没有尾巴”的好奇心。
“尽管很不幸,却是一个非常好的契机,让我觉得自己应该好好想一想这个问题。”夏波说。
尾巴的缺失是人类及“类人猿”进化谱系中发生的最显著的解剖学变化之一。已知最古老的灵长类动物化石距今约6600万年,这些“祖先”拥有成熟的尾巴,帮助其在树冠间来回穿梭时保持平衡。约在2500万年前,无尾猿才开始出现在化石记录中。
尽管人类丢失尾巴的历史很悠久,但关于我们是如何及为何失去尾巴的,仍是一个困扰科学家的谜团。因为很多人在思考这个谜团时,通常会陷入一个困境——以为尾巴的缺失是一个涉及身体构造巨大改变的复杂过程。
此外,由于过去的科学技术积累所欠,人们缺乏足够精确和全面的工具深入研究动物的基因组及发育过程,因此无法探究引起人类尾巴缺失的具体原因。直到近一个世纪开始,科学家们才逐渐积累了大量有关动物发育的基因信息及分析技术方法。
那么在遗传学上,我们的基因组到底发生了什么改变,才引起人类和猿类在进化过程中丢失了尾巴?对于夏波而言,这是一个非常有趣的问题。“我本身就对基因组调控非常感兴趣,又有遗传学和生物信息学的相关背景,所以就去看了相关文献。”夏波说。
于是,在意外受伤和好奇心的双重驱使下,夏波对这项课题展开了研究。
反向插入,灵光一闪
近几十年来,大量灵长类动物基因组已被测序。
夏波及研究团队做的第一件事情,就是在灵长类动物中寻找与尾巴发育有关的关键基因。得益于前人的积累,在对约2万个基因进行筛选之后,夏波先筛选出了约140个已知与尾巴发育相关的基因,并最终锁定到一个名为“TBXT”的基因。
TBXT基因,也被称作Brachyury,源自于希腊语,意思是“短尾”。TBXT基因编码的蛋白在胚胎发育过程中扮演着重要角色,它是一种转录因子,对脊索的形成及发育至关重要。早在1927年,乌克兰首都基辅出生的科学家Nadezhda Dobrovolskaya-Zavadskaya就发现TBXT基因突变的小鼠尾巴会变短或完全缺失。虽然直到大半个世纪后的1990年,德国科学家Bernhard Herrmann才成功鉴定出具体的Brachyury基因。Brachyury基因后来被统一命名为TBXT。
“当你在谷歌中搜索和尾巴发育相关,或是引起尾巴丢失的突变体基因,第一个找到的可能就是TBXT基因。”夏波说。
一般而言,基因片段中包含两类区域:外显子(编码区域)和内含子(非编码区域)。外显子是转录成RNA并最终编码蛋白质的DNA片段,而内含子是不编码蛋白质的DNA片段。在基因研究中,人们通常会将注意力放在编码蛋白质的基因序列上,因为它们直接提供合成蛋白质的序列蓝图,而蛋白质是细胞功能最重要的执行者。
但在夏波看来,尽管非编码区域的序列不直接编码蛋白质,但它们占据人类基因组约98.5%的区域,包含着对基因表达和调控至关重要的信息。“我们对基因组感兴趣,就不可能只关注在约1.5%的编码蛋白区域。”夏波告诉《中国科学报》。
当他将目光转向类人猿TBXT基因的非编码区域时,发现了一个可能是影响人类尾巴发育的强有力的怀疑对象——名为Alu元件的短DNA插入。
Alu元件的插入被视为一种基因突变。Alu元件是所谓“跳跃基因”的主要类型之一,可以在基因组中移动。它们的活动影响着基因组的结构变化,从而导致遗传变异。这种基因在人类基因组中很常见,有超过100万个拷贝数,约占人类DNA总长度的10%。夏波发现的这一个具体拷贝AluY,只存在于类人猿的TBXT基因里,而猴子基因里却没有。
由于这个Alu的插入发生在TBXT基因非编码区域的中间,夏波将其比喻为“in the middle of nowhere(荒芜之境)”。
“我猜有前人也看到过这些突变,但可能觉得这类非编码序列不会有什么功能,就没有继续。然而,当我注意到Alu的插入需要和另外一段突变成对,才能把编码蛋白的一段序列去掉时,才是真正灵光一现的瞬间。”夏波说。
研究团队发现,促成尾巴缺失其实需要两个Alu元件:相对年轻的“AluY”和更古老的“AluSx1”,类人猿和猴类共有后者。AluY和AluSx1分别位于TBXT基因第6个外显子(Exon 6)的下游和上游。而这两个Alu元件必须共同合作,反向黏合在一起形成茎环结构,才能促成第6个外显子的缺失。
“这种缺失是基因的可变剪切事件,它生成了较短的TBXTΔexon6转录本,从而影响类人猿尾巴的发育。缺少其中任何一个Alu元件都无法生成TBXTΔexon6转录本。”夏波解释道。
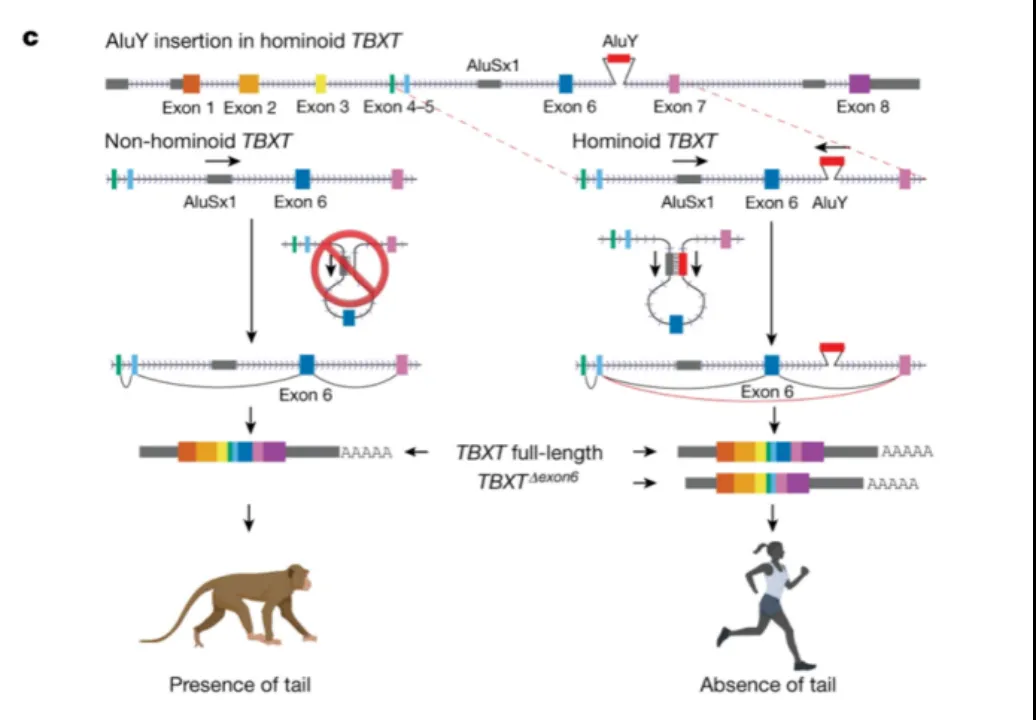
AluY插入类人猿TBXT基因。图源Nature论文
夏波还将基因的可变剪切事件生动地比作电影剪辑:“电影导演通过对电影镜头的剪辑、拼接呈现故事情节,基因本身的序列也如同电影拍摄阶段已捕获未经处理的镜头。导演可以通过剪辑拍摄内容从而讲述相似但是结局完全不同的故事。基因序列的可变剪切产物的不同最终会影响基因的表达、生物体的功能和特征。”
享受研究,追随兴趣
这项研究始于2019年的秋天,作为夏波博士论文的一部分,前后经历了约两年时间。早在2021年9月,研究团队就已经将该研究工作以预印本的形式公布在BioRxiv上并投稿至Nature。
论文获得了同行评审的高度赞赏,但文章并没有立即发表,因为他们还需要做一些新的小鼠模型,以证明基因变化具有预期的效果。
2022年,夏波因工作原因从纽约搬去了波士顿。新冠疫情的冲击和远程沟通的困难增加了团队之间的协作难度,又因为培养小鼠较为耗时,致使论文发表时间一拖就是两年。
要知道,科研领域竞争激烈,发表时间也至关重要。通常会有多个团队在同一时间尝试解决相似的科学问题,先发表结果可能会在学术界获得更多的关注和认可。
然而,夏波似乎没有这样的担忧。在他看来,预印本论文为科学交流带来了诸多好处:一方面,它允许研究人员快速分享研究成果,侧面也形成了一种保护机制;另一方面,它为同行提供了及时获取最新进展的机会。“据我所知,已经有不少课题组因为我们的发现,陆续开展了新的研究工作。”
再回忆起这段研究经历时,夏波坦言,这项研究有些“无心插柳柳成荫”。
事实上,夏波从未想过一定要解开人类尾巴的谜题,纯粹是兴趣所致,甚至有些“玩”的心态。他很享受做这项研究的过程:“很神奇的研究经历。对我来说,有机会解答一个大多数人都感兴趣的问题,并且能够以一种易于理解的方式展示解决方案,这是非常难得的机会。”
夏波2013年本科毕业于中国农业大学。本科期间他曾在北京大学生命科学学院伊成器实验室学习工作过。2015年,夏波前往美国纽约大学医学院深造,分别于2017年和2022年获得该校生物专业的硕士及博士学位。
尽管夏波的科研生涯一直以生物研究为主线,但他本人却展现出强烈的跨学科倾向。
“最初,我想要去研究化学。但因为一些人生际遇,转而学了生物。”但扎实的化学背景为夏波探索生物学提供了重要的跨学科研究思路。在伊成器实验室学习工作时,他就曾借用经典的化学反应开发了一系列研究DNA修饰的测序方法。
一路走来,夏波涉足了许多交叉学科的研究。他会特意给自己一些跨学科训练,包括阅览不同科学领域的文献或是聆听讲座。
“我认为,做跨学科研究成功的关键还是好奇驱动。尽管我很难保证对每一个领域的内容都感兴趣,但是这种跨领域的接触常常给我提供从不同角度思考问题的机会。有时候,新的想法就是在这个过程中碰撞出来的。”
如今,34岁的夏波已经在哈佛大学、Broad研究所建立了自己的实验室。打开实验室官网会发现,他的团队同样展现出强烈的跨学科特色——来自计算机科学、化学生物学、机械工程、生物工程、分子生物学等不同科研背景的成员灵活交流、分工合作,向包括“人类丢失尾巴”这样有趣的科学问题在内的基因组学调控原理发起探索。
论文链接:
https://doi.org/10.1038/s41586-024-07095-8

















