难治的阿尔茨海默病(AD),终于又被科学家撕开了一个大口子!
今天,由斯坦福大学医学院Katrin I. Andreasson领衔的研究团队,在顶级期刊《科学》上发表一项重磅研究成果[1]。
他们发现,阿尔茨海默病的两个重要病理毒蛋白Aβ寡聚体和tau寡聚体,竟然会激活星形胶质细胞的IDO1酶,进而抑制星形胶质细胞的糖酵解,导致神经元的重要“燃料”——乳酸生成受阻。
有意思的是,抗癌药IDO1抑制剂可以恢复星形胶质细胞的糖代谢,促进乳酸生成,拯救海马体神经元突触的可塑性。更神奇的是,无论是Aβ病理驱动的AD小鼠模型,还是tau病理驱动的AD小鼠模型,IDO1抑制剂均可以在不改变大脑Aβ或tau水平的情况下,改善所有模式小鼠的认知。
鉴于多种神经退行性疾病均存在大脑能量代谢异常现象,因此靶向IDO1的药物有望成为治疗神经退行性疾病的通用疗法。
▲ 论文首页截图
众所周知,Aβ病理和tau病理是驱动阿尔茨海默病的两个关键病理过程,它们会导致患者突触和神经回路出现进行性和不可逆的丧失。
目前,阿尔茨海默病治疗领域研究最深入、进展最快的,是靶向Aβ病理的药物,其次是靶向tau病理的药物。虽然已经有很多研究发现,脑葡萄糖代谢的持续下降会与阿尔茨海默病不同病理现象同时出现;但是我们对大脑能量代谢异常与阿尔茨海默病之间的关系,仍然认识不足。
Andreasson团队在整理文献治疗后发现,阿尔茨海默病患者星形胶质细胞的代谢显著紊乱。要知道,星形胶质细胞生产的乳酸,不仅是神经元的重要能量来源,还支持突触的活动。此外,他们还注意到,星形胶质细胞表达但神经元不表达的代谢酶IDO1,与包括阿尔茨海默病在内的多种神经退行性疾病有关。
以上的种种表明,阿尔茨海默病、星形胶质细胞代谢紊乱、IDO1三者之间肯定存在某种还不为人所知的关系。为了探明它们之间的关系,Andreasson团队先用Aβ寡聚体(oAβ)和tau寡聚体(oTau)单独或联合处理小鼠的星形胶质细胞。
他们观察到,无论是单独处理还是联合处理,IDO1的mRNA水平都升高,而且依赖于IDO1的犬尿氨酸(KYN)水平也增加。在人星形胶质细胞中,也可观察到类似的反应。此外,如果用IDO1抑制剂(PF068)处理星形胶质细胞,就会抑制犬尿氨酸的形成。
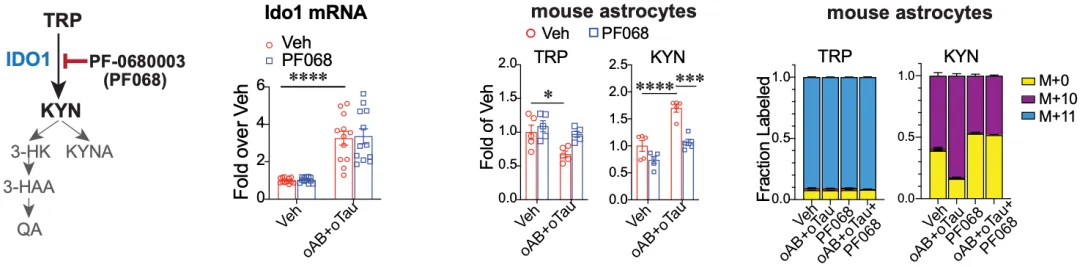
▲ Aβ和tau寡聚体对星形胶质细胞代谢的影响
Andreasson团队很快就证实,Aβ和tau寡聚体的刺激下,星形胶质细胞犬尿氨酸水平升高不是一件好事儿。
因为犬尿氨酸会与芳基烃受体(AhR)结合并触发AhR转位至细胞核,促使AhR与AhR核转运体(ARNT)二聚化。如此一来,调节糖酵解相关基因转录的缺氧诱导因子1-α(HIF1α)就不能与ARNT结合,糖酵解相关基因的表达被抑制,乳酸生成受阻。
不过,IDO1抑制剂可以恢复Aβ和tau寡聚体处理后的星形胶质细胞糖酵解相关基因的表达,提升乳酸产量。
以上结果说明,星形胶质细胞的葡萄糖代谢是Aβ和tau寡聚体通过IDO1依赖性机制破坏的。这一下子就让三者紧密联系在一起了。

▲ Aβ和tau寡聚体调节星形胶质细胞代谢的机制示意图
接下来的问题是,阿尔茨海默病病理毒蛋白诱导的星形胶质细胞代谢紊乱,是阿尔茨海默病患者认知受损的原因吗?
他们首先证实IDO1抑制剂PF068可以穿过小鼠的血脑屏障,并以剂量依赖的方式降低海马体中犬尿氨酸(KYN)水平,增加乳酸盐水平。这说明,PF068这个药物可以用于体内实验。
随后,他们构建了三种AD小鼠模型,其中两个是Aβ病理驱动的(APP/PS1和5XFAD),另一个是tau病理驱动的(PS19)。总体来看,这三种AD小鼠模型的海马体中都出现了犬尿氨酸增加和乳酸减少的现象;而IDO1抑制剂PF068处理,可以逆转这个现象。
尤其值得注意的是,PF068处理可以恢复三种AD小鼠模型受损的空间记忆和长时程增强(LTP)作用。
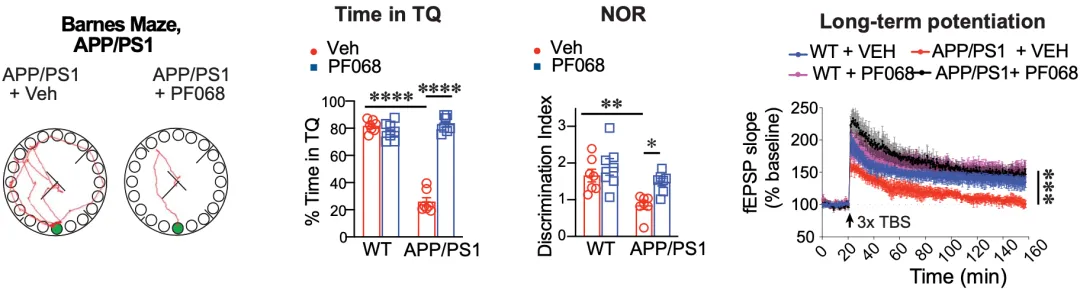
▲ IDO1抑制剂可改善AD小鼠模型的认知
在分析三种AD小鼠模型大脑内Aβ病理和tau病理时,Andreasson团队发现,在两种Aβ病理AD小鼠模型中,抑制IDO1并不影响脑Aβ40和Aβ42的总量;不过,海马下托区的致密斑块和松散斑块却减少了。这说明,Aβ的聚集状态受到了影响。
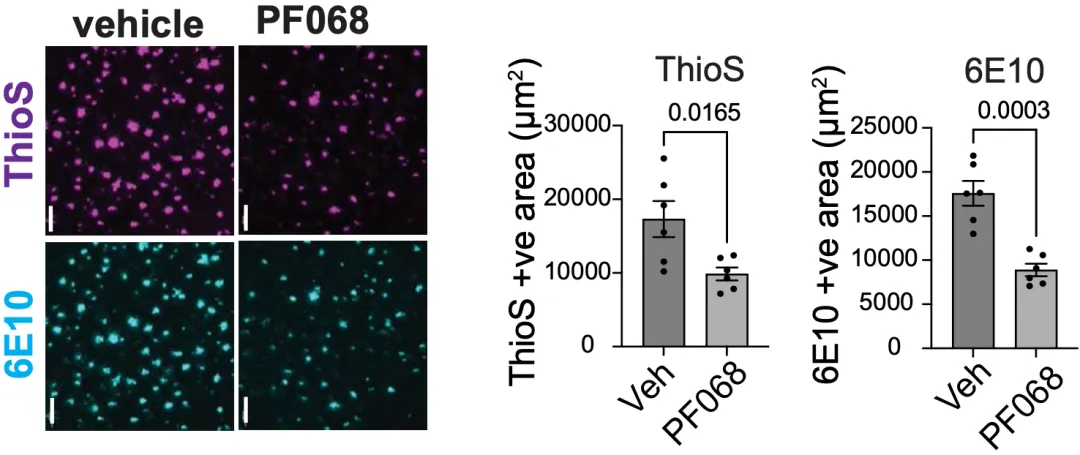
▲ 致密斑块(ThioS)和松散斑块(6E10)的变化
从tau病理AD小鼠模型来看,在IDO抑制剂处理之后,可溶性和不可溶性tau的水平也没有发生变化,但是可溶性tau中,231位苏氨酸被磷酸化的tau水平降低了;不可溶性tau中,181或231位苏氨酸被磷酸化的tau水平降低了。
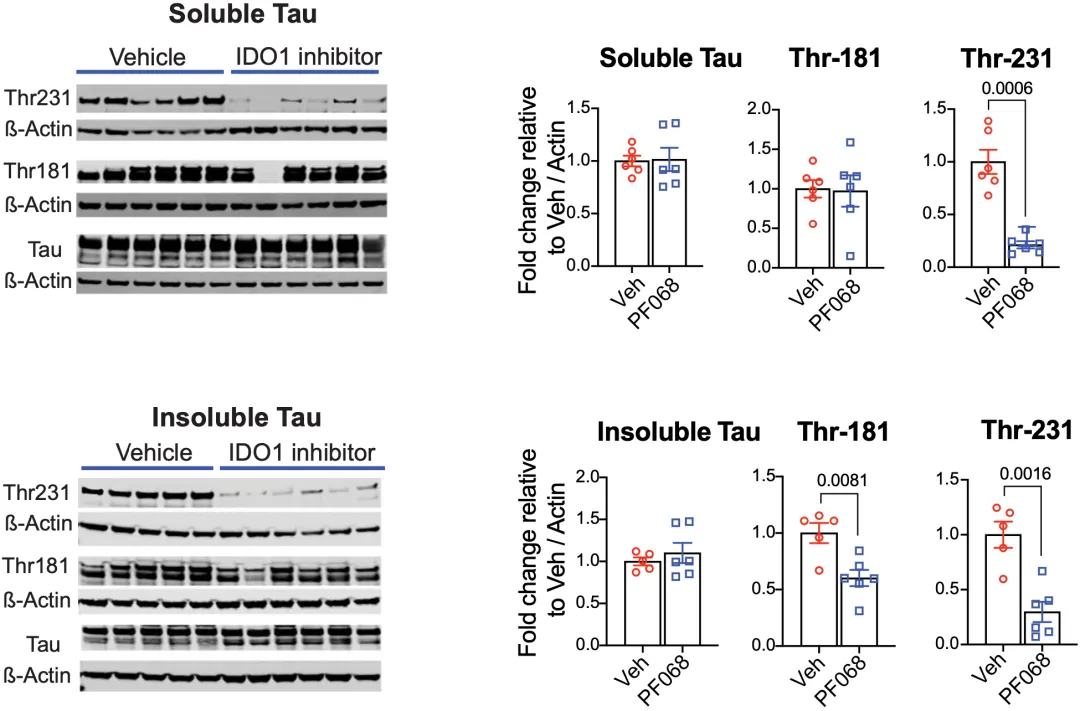
▲ IDO抑制剂对tau的影响
以上结果说明,Aβ病理和tau病理都是通过影响IDO1的活性,抑制了星形胶质细胞的糖酵解代谢,导致乳酸水平降低,最终影响了认知。
不过这中间还缺失一环。那就是IDO1改善AD小鼠模型的认知,是通过促进乳酸生成给神经元供能实现的么?
为了打通这最后一个环节,Andreasson团队采用了MCT1/2抑制剂(AR-C155858),阻断乳酸从星形胶质细胞向神经元的转移。正如研究人员所料,MCT1/2抑制剂抵消了PF068对海马体长时程增强(LTP)作用的改善。
简单总结一下机制:Aβ病理和tau病理会激活星形胶质细胞IDO1酶,导致色氨酸(TRP)被代谢成犬尿氨酸(KYN),抑制糖酵解过程和乳酸产生,导致神经元供能不足,突触可塑性受损,认知出现障碍;而抑制IDO1,可以在不顾Aβ病理和tau病理的情况下,逆转上述一些列变化,改善认知。

▲ 机制示意图
在研究的最后,Andreasson团队在晚发型阿尔茨海默病患者的脑组织中,证实上述机制也存在与人体内。这也为IDO1抑制剂治疗阿尔茨海默病临床研究的开展奠定了基础。
总的来说,Andreasson团队的这项研究成果表明,IDO1在阿尔茨海默病患者大脑葡萄糖代谢中发挥着非常重要的作用,开发可以穿过血脑屏障的IDO1抑制剂,有望为阿尔茨海默病的治疗带来全新的希望。
值得注意的是,这个研究还表明,星形胶质细胞的这种代谢异常,可能是一种跨病理/疾病类型的普遍性现象,有望成为治疗多种神经退行性疾病的通用疗法。
期待Andreasson团队的后续研究成果。

















