药明康德内容团队编辑
近日,美国FDA药物评价和研究中心(CDER)发布了2024年度的新药获批报告。FDA旗下CDER在2024年共计批准50款创新疗法,超过过去10年的平均水平(47款)。其中,用于治疗罕见疾病和罕见癌症的新药占比超过50%,展现了FDA致力于解决罕见病相关未竟医疗需求方面的努力。在今天的文章中,药明康德内容团队将结合公开资料,回顾2024年FDA批准疗法的亮点,并展望2025年有望获批的潜在“first-in-class”疗法。
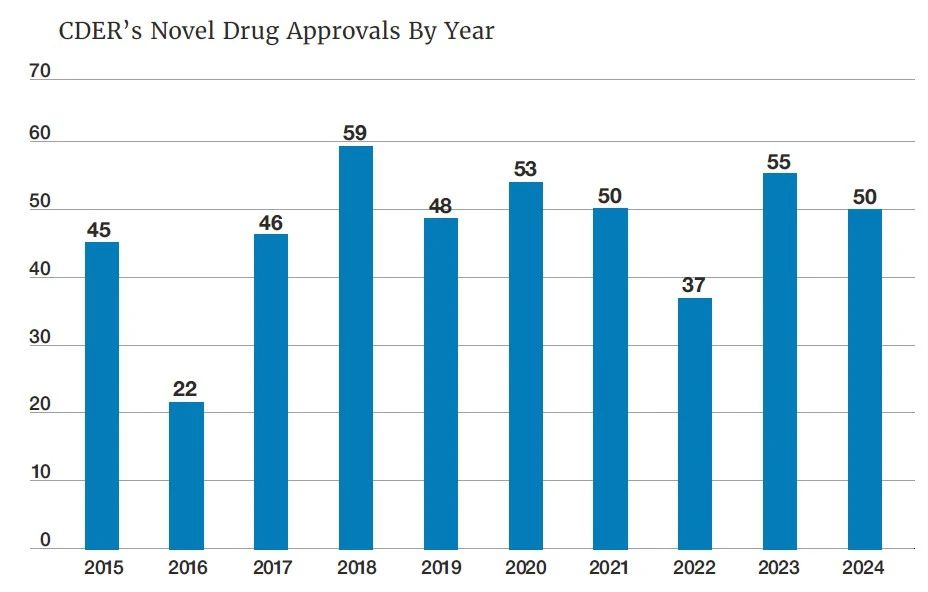
▲2015-2024年CDER批准的创新药物数量(图片来源:参考资料[1])
从创新角度来看,CDER在2024年批准的50款新药中,24款被认定为“first-in-class”新药。这些新药采用了与已有疗法不同的作用机制。FDA的报告中着重介绍了下面几款“first-in-class”创新药物。
Anktiva(nogapendekin alfa inbakicept)是一款白细胞介素-15(IL-15)超级激动剂。它获得批准与卡介苗(BCG)联合使用,用于治疗对BCG无应答且伴有原位癌(CIS)的非肌层浸润性膀胱癌(NMIBC)成年患者,这些患者伴或不伴有乳头状肿瘤。在2/3期临床试验中,接受治疗的患者完全缓解率达62%。
Cobenfy(xanomeline和trospium chloride)获得FDA批准治疗精神分裂症成人患者。它是靶向胆碱能受体的首个抗精神病药物(antipsychotic drug),长期以来精神分裂症的标准疗法靶向多巴胺受体。该疗法也标志着过去数十年来首个治疗精神分裂症的新机制药物。
Nemluvio(nemolizumab)是一款靶向白介素-31(IL-31)受体的单克隆抗体,获得FDA批准用于成人结节性痒疹(prurigo nodularis)患者。它是首款获得FDA批准用以抑制IL-31信号的单克隆抗体。
Revuforj(revumenib)是一种针对menin-KMT2A相互作用的强效、选择性小分子抑制剂。它获得FDA批准治疗携带KMT2A易位的复发或难治性(R/R)急性白血病成人和1岁以上儿童患者。Revuforj是首款获批的menin抑制剂。
Rezdiffra(resmetirom)是一款每日一次、口服甲状腺激素受体(THR)-β选择性激动剂,获得FDA加速批准治疗患有中重度肝纤维化(F2至F3期)的非肝硬化非酒精性脂肪性肝炎(NASH)/代谢功能障碍相关脂肪性肝炎(MASH)成人患者。这是获得FDA批准的首款NASH疗法,标志着该领域的一项重要里程碑。
Tryvio(aprocitentan)是一款靶向双重内皮素(endothelin)受体的口服拮抗剂。它获得批准与其他抗高血压药物联合,用以治疗使用其他药物无法充分控制血压的成年高血压患者。这款药物是30年来首个获批基于新机制的降血压药物。
FDA加速罕见病药物的开发与审评
2024年,CDER批准的50款新药中有26款(52%)获得孤儿药资格,这些药物专门针对罕见疾病——即患者总数不足20万人的疾病。对于这些罕见疾病患者来说,他们通常面临着极其有限或完全缺乏有效治疗选择的困境。
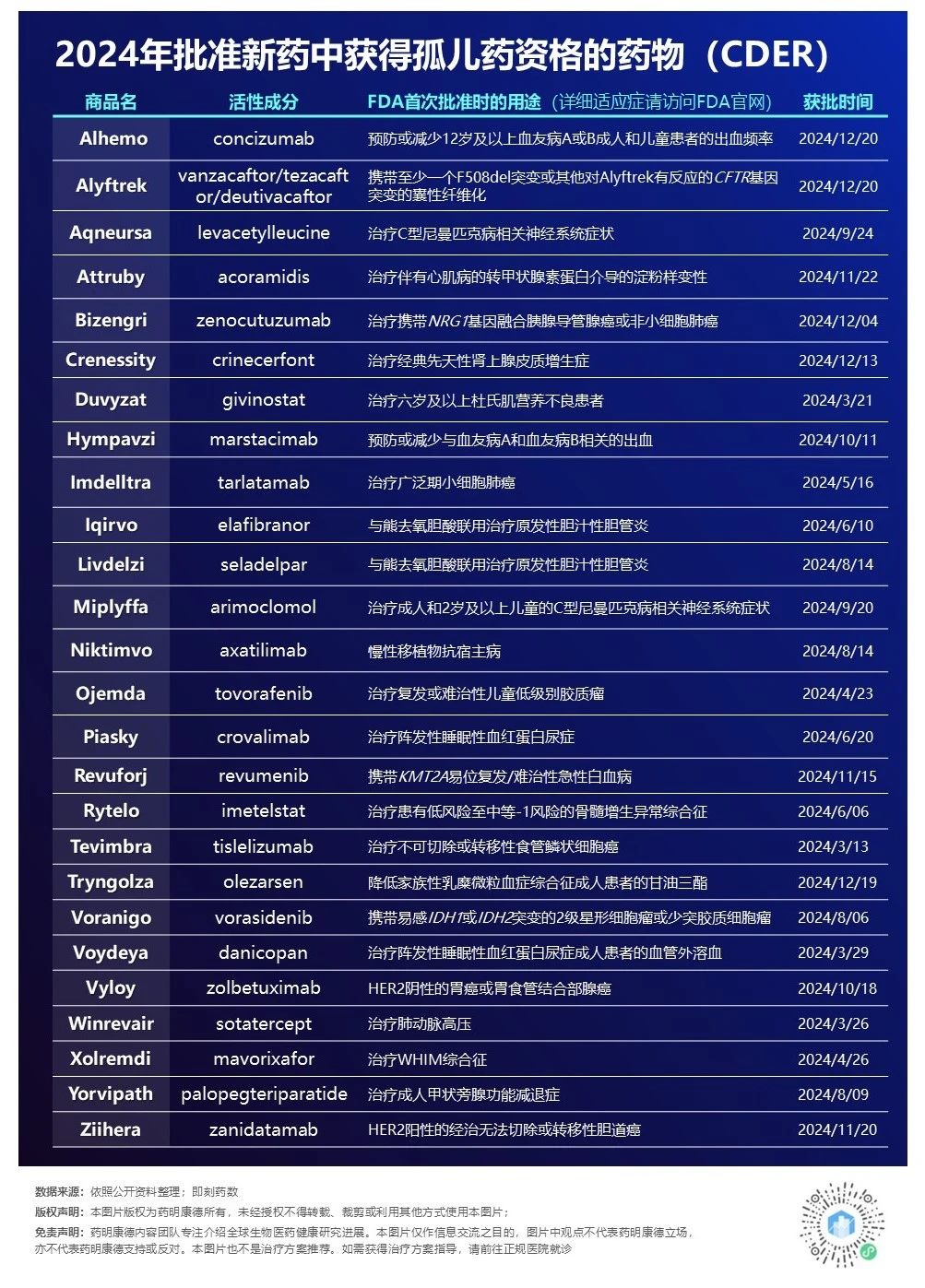
▲2024年CDER批准的获得孤儿药资格的罕见病疗法(数据来源:公开资料,药明康德内容团队制图)
FDA采用多种方式促进和加快新药审评
在2024年,CDER采用了多种监管策略来加快药品的审评流程。在2024年获批的50款新药中,有22款(44%)获得快速通道资格,18款(36%)获得突破性疗法认定,28款(56%)获得优先审评资格(不包括使用优先审评券递交监管申请的药物),7款药物(14%)获得加速批准,33种新药(66%)使用了一个或多个加快审评过程的资格认定。
加速批准旨在以比传统审评路径更快的速度,推动解决未满足医疗需求的某些药物上市。对于符合加速批准路径的药物,其安全性和有效性评估将不基于直接临床获益的指标,而是基于可能预测临床获益的替代终点或中间临床终点。2024年,CDER利用这一渠道批准了7款创新药。
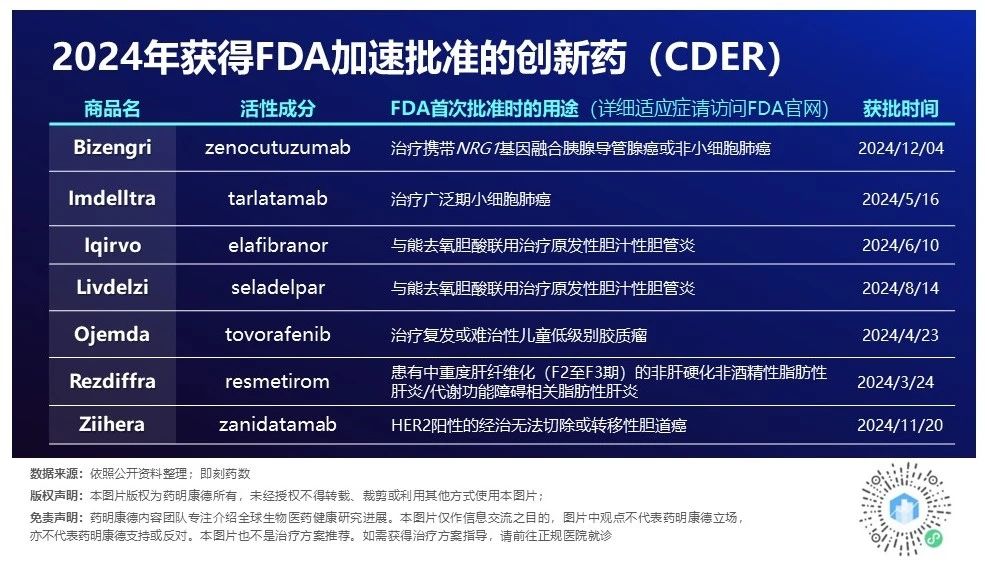
▲2024年CDER加速批准的创新药(数据来源:公开资料,药明康德内容团队制图)
2025年,哪些潜在“first-in-class”疗法值得期待?
疗法:Donidalorsen
公司:Ionis Pharmaceuticals
目标适应症:遗传性血管性水肿
Donidalorsen是一款反义寡核苷酸配体偶联(LICA)药物,旨在精确沉默前激肽释放酶(PKK)的表达,中断导致遗传性血管性水肿(HAE)发作的信号通路。在3期临床试验OASIS-HAE中,接受每四周一次donidalorsen(80毫克)治疗的患者与安慰剂相比,在第1至第25周内将患者月均HAE发作率降低81%(p<0.001)。
疗法:Fitusiran
公司:赛诺菲,Alnylam Pharmaceuticals
目标适应症:血友病A和血友病B
Fitusiran是一款RNAi疗法,旨在作为体内产生/未产生凝血因子抑制物的血友病A或血友病B患者的预防性治疗。Fitusiran可降低抗凝血酶水平,从而促进凝血酶生成,重新平衡止血功能并预防出血。在两项3期临床研究中,与对照组相比,每月一次皮下注射fitusiran预防治疗组患者的年化出血率降低了90%。
疗法:Mirdametinib
公司:SpringWorks Therapeutics
目标适应症:神经纤维瘤病1型相关的丛状神经纤维瘤
Mirdametinib是一种口服别构小分子MEK抑制剂,靶向MEK1和MEK2。美国FDA已接受SpringWorks递交的新药申请并授予其优先审评资格。关键性2b期临床试验ReNeu数据显示,接受mirdametinib治疗的儿童患者客观缓解率为52%,成人患者为41%。ReNeu试验中的儿童和成人患者的疼痛、生活质量和身体功能较基线有统计学上显著的改善。
疗法:Plozasiran
公司:Arrowhead Pharmaceuticals
目标适应症:家族性乳糜微粒血症综合征
Plozasiran是一款靶向APOC3基因的潜在“first-in-class”RNAi疗法。APOC3是富含甘油三酯脂蛋白(TRL)的组成部分,也是甘油三酯代谢的关键调节因子。APOC3通过抑制脂蛋白脂肪酶分解TRL以及肝脏受体吸收TRL残留物来增加血液中的甘油三酯水平。Plozasiran治疗目标是通过下调APOC3降低甘油三酯水平。Arrowhead Pharmaceuticals日前宣布,FDA已接受为plozasiran递交的新药申请,用于治疗家族性乳糜微粒血症综合征。
疗法:Suzetrigine
公司:Vertex Pharmaceuticals
目标适应症:中重度急性疼痛
Suzetrigine是一种口服选择性NaV1.8抑制剂,与其它NaV离子通道相比,它对NaV1.8具有高度选择性。NaV1.8是在外周神经系统的痛觉信号传导中起到关键性作用的电压门控钠通道。它是经过遗传学验证的疼痛治疗靶点。Vertex的策略是通过选择性抑制NaV1.8,开发新的药物类型。与阿片类药物相比,它们可能在提供更好镇痛效果的同时,避免上瘾等副作用。2024年7月,美国FDA接受了Vertex为该疗法递交的NDA,并授予其优先审评资格,预计在2025年1月30日之前完成审评。
疗法:Telisotuzumab vedotin
公司:艾伯维
目标适应症:c-Met蛋白过度表达的经治局部晚期或转移性非鳞状非小细胞肺癌(NSCLC)
Telisotuzumab vedotin是一款靶向c-Met的抗体偶联药物,以微管蛋白抑制剂MMAE作为毒性有效载荷。艾伯维已经向美国FDA提交了telisotuzumab vedotin的生物制品许可申请,寻求加速批准,用于治疗c-Met蛋白过度表达的经治局部晚期或转移性非鳞状NSCLC成人患者,这些患者肿瘤的表皮生长因子受体(EGFR)为野生型。此前公布的2期临床试验数据显示,肿瘤c-Met高度表达和中度表达患者的总缓解率分别为35%和23%。
疗法:UGN-102
公司:UroGen Pharma
目标适应症:低级别中等风险非肌层浸润性膀胱癌
UGN-102膀胱灌注液是一种创新的丝裂霉素(mitomycin)药物。该疗法利用UroGen专有的RTGel技术,这种基于水凝胶的持续释放制剂可使膀胱组织能够更长时间地暴露于丝裂霉素之下,从而通过非手术手段治疗肿瘤。在3期临床试验中,接受UGN-102治疗患者在首次灌注后三个月的完全缓解率为79.6%(95% CI:73.9-84.5)。FDA预计在今年6月13日之前公布审评结果。
疗法:UX111
公司:Ultragenyx Pharmaceutical
目标适应症:IIIA型黏多糖贮积症
UX111是一种用于治疗IIIA型黏多糖贮积症的新型体内基因疗法。它旨在通过一次性静脉输注完成给药,使用AAV9载体将表达N-磺基葡萄糖胺磺基水解酶(SGSH)的转基因递送至细胞中。Ultragenyx Pharmaceutical公司已向美国FDA提交了生物制品许可申请,寻求加速批准UX111。关键性Transpher A研究的数据显示,接受UX111治疗后,患者脑脊液中的硫酸乙酰肝素(HS)水平迅速且持续降低,且这一生物标志物的持续降低与长期认知发育的改善相关。
除了上述内容,CDER的报告还详细概述了2024年关于新药批准的PDUFA目标日期的准时达成情况、药物适用范围的扩展批准,以及对生物类似药的审评情况。欲了解更多详情,可点击文末“阅读全文/Read more”下载报告全文。
展望2025年,我们期待更多创新疗法的批准,为全球患者带来新的治疗选择。

















