
第一作者:Deyi Wang
通讯作者:Ning Gao; Zehuan Huang
单 位:北京理工大学化学与化学工程学院;北京大学材料科学与工程学院
Part 1 研究背景
生物分子凝聚体(也称为无膜细胞器)是通过液-液相分离(LLPS)形成的超分子集合,在细胞组织和代谢网络中发挥着关键作用。LLPS及其相关的组装和去组装过程通常受超分子相互作用的调节。内在无序蛋白(IDPs)是能够经历LLPS的主要生物分子类别。尽管IDPs的组装机制尚未完全阐明,但普遍认为超分子相互作用是IDPs LLPS的主要驱动力。LLPS和相关的生物分子凝聚体组装/去组装过程是动态和可逆的,依赖于动态LLPS来执行生物学功能。重建动态LLPS系统对于理解细胞组织、分析细胞功能和设计生物启发材料具有重要意义。但由于IDPs的复杂和无序结构以及它们结构的快速变化,重建受超分子调节的动态LLPS系统并定量说明分子相互作用的变异性具有挑战性。
Part 2 文章简介
本文主要研究了一种名为Nap-o-Nap的简化相分离分子,该分子能够在生理条件下发生液-液相分离(LLPS),并通过与Cucurbit[7]uril和1-Adamantylamine的竞争性主-客体相互作用,实现相分离的可逆调控。这种调控方法不仅能够定量地阐明LLPS过程中分子间相互作用的变异性,还能通过选择性地招募或排除客户分子来调节酶的活性,从而编排生物酶动力学。
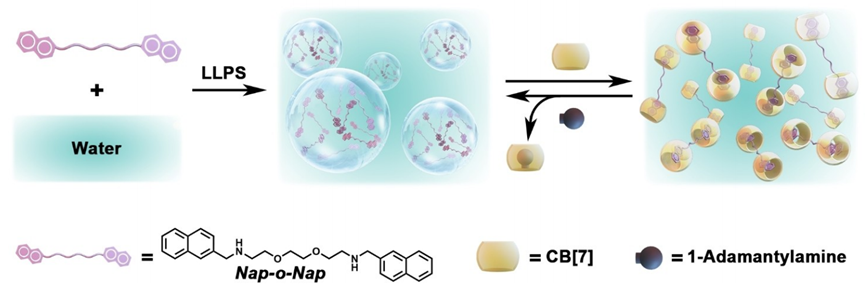
示意图. Nap-o-Nap的LLPS与超分子开关的可逆LLPS
Part 3 本文要点
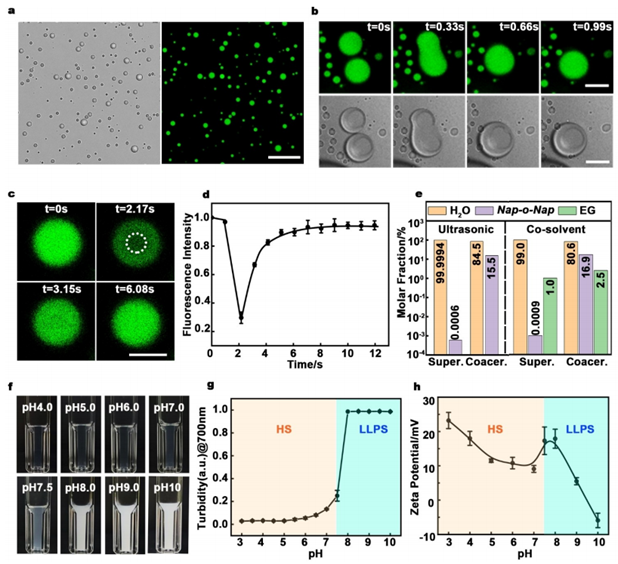
图1. Nap-o-Nap分子在进行液-液相分离(LLPS)的过程及其相关特性
要点一:当Nap-o-Nap分子被加入到去离子水或含水盐溶液中,并经过超声或剧烈震动后,溶液变得浑浊,形成了直径为1-3微米的共凝聚微滴。在微滴接触时,它们会自发融合成更大的微滴,并最终在几秒钟内变形为球形。通过荧光恢复后漂白(FRAP)实验,观察到微滴被光漂白后荧光强度迅速恢复,10秒内恢复到约94.5%的原值,证实了微滴的液体性质。通过核磁共振(NMR)和溶剂蒸发法,定量分析了浓缩相和上清相的组成,发现浓缩相主要由Nap-o-Nap和水组成,而上清相几乎不含Nap-o-Nap,表明了明显的浓度梯度。浊度测量,观察到Nap-o-Nap共凝聚微滴在pH值低于7.5时为均匀溶液,而在pH值约为7.5时发生LLPS。Zeta电位测量显示,随着pH值的降低,Zeta电位略有下降,表明从LLPS到均匀溶液的相变。
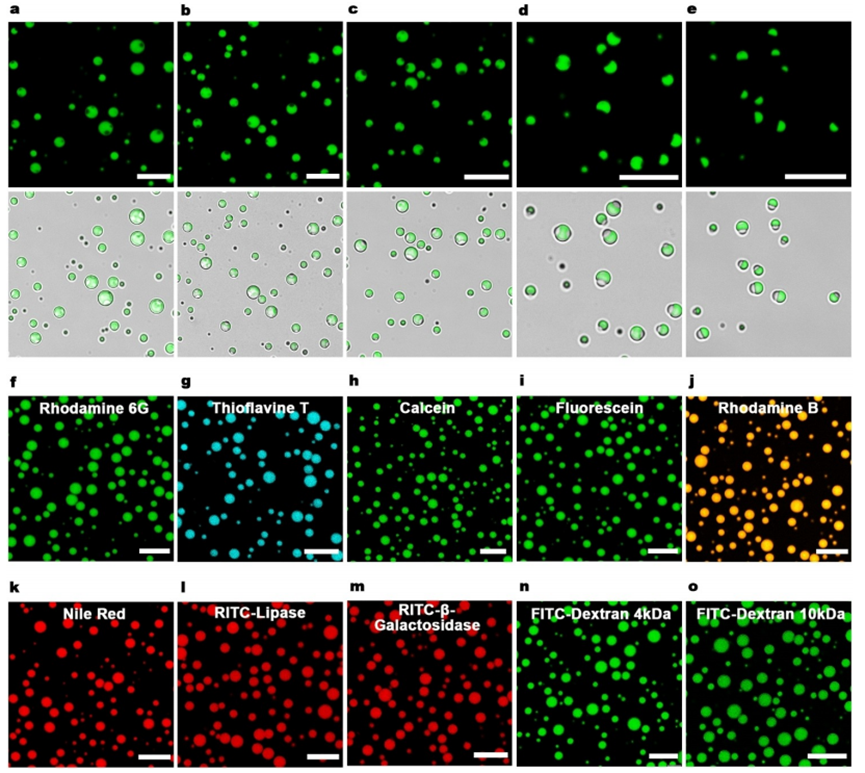
图2. Nap-o-Nap 共聚物微滴的多相分离与分子选择性富集
要点二:作者过将Nap-o-Nap溶液与不同体积的共溶剂(DMF)混合,实现了多相分离,形成了具有不同形态的多相共聚物微滴。随着DMF浓度的降低而变化,这些微滴的形态从Janus形、碗形到多相结构。激光扫描显微镜(CLSM)观察到,这些多相微滴保持了共聚物的特性,如球形结构、荧光恢复实验(FRAP)和荧光富集特性。将Nap-o-Nap共聚物微滴与各种客体分子(如Rhodamine 6G、Thioflavine T、Calcein、Fluorescein、Rhodamine B、Nile Red、Lipase、β-Galactosidase和Dextran)混合,证明了共聚物微滴对各种分子的选择性富集能力,特别是那些具有疏水特性和芳香基团的分子。
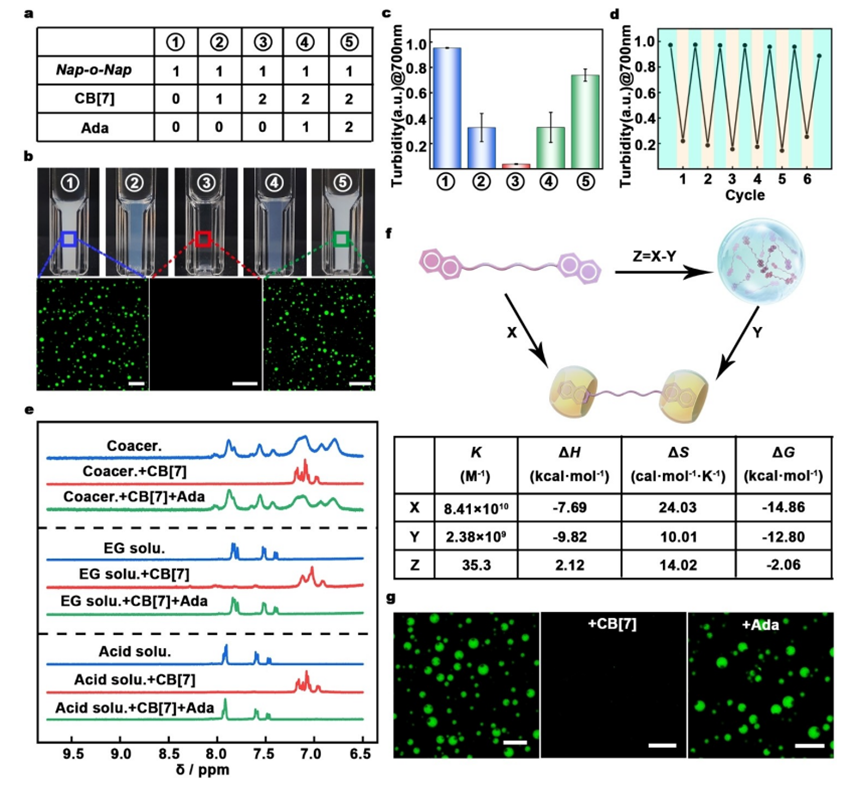
图3. 超分子调控实现的液-液相分离(LLPS)的组装、解组装和再组装循环
要点三:首先,Nap-o-Nap在水中发生相分离,形成浑浊的溶液,随后加入CB[7]导致共聚物解组装,溶液变清。接着,加入Ada使溶液重新变浑浊,表明共聚物重新组装。通过添加CB[7]和Ada实现的动态LLPS循环。随着CB[7]和Ada的添加,溶液的浊度变化,表明共聚物的组装和解组装循环。过1H NMR光谱验证CB[7]、naphthalene和Ada之间的主-客体相互作用。当CB[7]加入Nap-o-Nap共聚物时,naphthyl质子峰变窄并上移,表明naphthyl基团被封装在CB[7]腔内。加入Ada后,质子峰再次变宽,表明LLPS发生。等温滴定热法(ITC)定量分析LLPS过程中分子相互作用的变化。结果显示,主-客体结合能(ΔGx)高于Nap-o-Nap的LLPS结合能(ΔGz),表明LLPS过程主要受熵驱动。通过添加CB[7]和Ada实现的多相共聚物的组装、解组装和再组装循环。这表明超分子调控对多相分离微滴也有效。
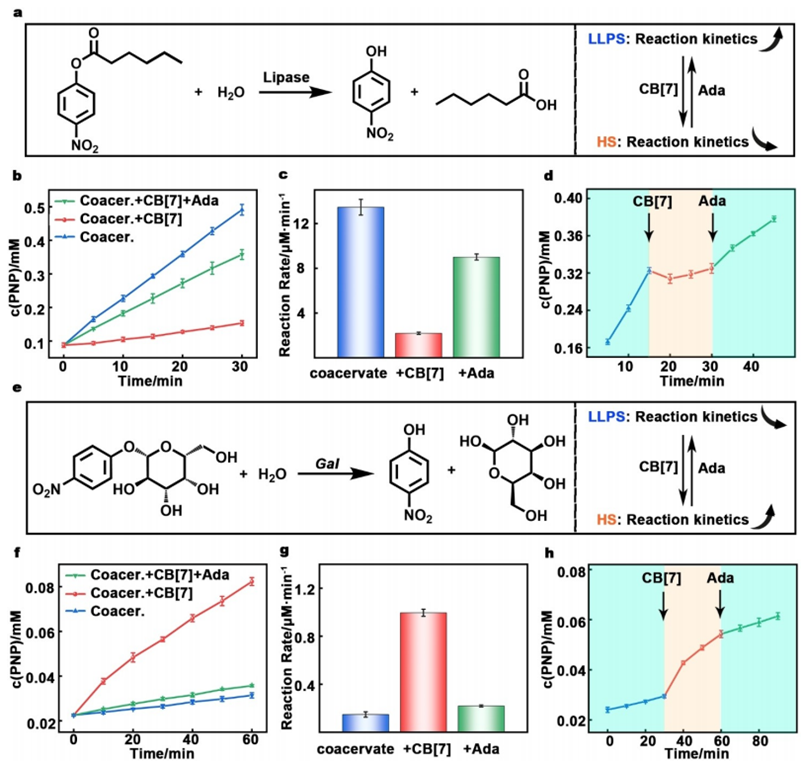
图4. 超分子调控液-液相分离(LLPS)来调节酶反应
要点四:作者通过LLPS调节酯酶催化的4-硝基苯己酸(4-NH)的水解反应。在三种不同系统(LLPS系统、非LLPS系统、LLPS后重新组装的系统)中4-NH水解反应的动力学曲线。显示了三种系统中酶反应的平均水解速率有所不同,在LLPS系统中,酶反应速率加快;在非LLPS系统中,酶反应速率减慢;在LLPS后重新组装的系统,酶反应速率恢复。在LLPS系统中,通过引入CB[7]和Ada来动态调控酶反应的过程。首先,引入CB[7]使LLPS解体,酶反应速率降低;然后,引入Ada重新组装LLPS,酶反应速率恢复。作者又进行了β-半乳糖苷酶催化的p-硝基苯-β-D-吡喃半乳糖苷(pNPG)水解反应的方案。通过测试三种系统中pNPG水解反应的动力学曲线。发现三种系统中酶反应的平均水解速率。在LLPS系统中,酶反应速率减慢;在非LLPS系统中,酶反应速率加快;在LLPS后重新组装的系统,酶反应速率恢复。在LLPS系统中,通过引入CB[7]和Ada来动态调控酶反应的过程。首先,引入pNPG启动酶反应,然后引入CB[7]使LLPS解体,酶反应速率加快;最后,引入Ada重新组装LLPS,酶反应速率恢复。
Part 4 总结与展望
本文通过设计一种名为Nap-o-Nap的小分子,实现了可逆的液-液相分离(LLPS),并通过主客体相互作用调节其相分离过程。研究发现,LLPS过程主要受熵驱动,且主客体相互作用比Nap-o-Nap的相分离更强,从而实现了对LLPS过程的调节。利用这种可调节的LLPS,可以有效地调控酶的活性,从而操控生物酶的动力学,为设计细胞模拟生物材料提供了新的思路。
原文链接
https://doi.org/10.1002/anie.202422601

















