在我们的日常生活中,常听到一句话:“有压力,才有动力。”仿佛压力成了一种正面的驱动力,是成功人士的标配,是进步的燃料。但现实却并不总是这样。在这个节奏快得像开了倍速播放的社会里,压力已经不是“可控刺激”,而更像是无孔不入的“慢性毒素”——它来自工作、学业、家庭、人际。
中山大学肿瘤防治中心的研究团队近日发表于Nature Cell Biology的研究[1]把这种“毒性”刻画得触目惊心:持续的疼痛感、束缚刺激或慢性不可预测的应激,都会激活交感神经,释放去甲肾上腺素(NA),进而压低RNA去甲基化酶Alkbh5的表达,让胰腺癌细胞的m⁶A修饰水平迅速上升。这些被重新标记的RNA又被癌细胞装进外泌体输送给周围神经,反过来促进神经生长,为肿瘤扩张“铺路搭桥”。压力,不仅没让我们更强,反而在某些情况下,正在“帮”癌症变得更凶。

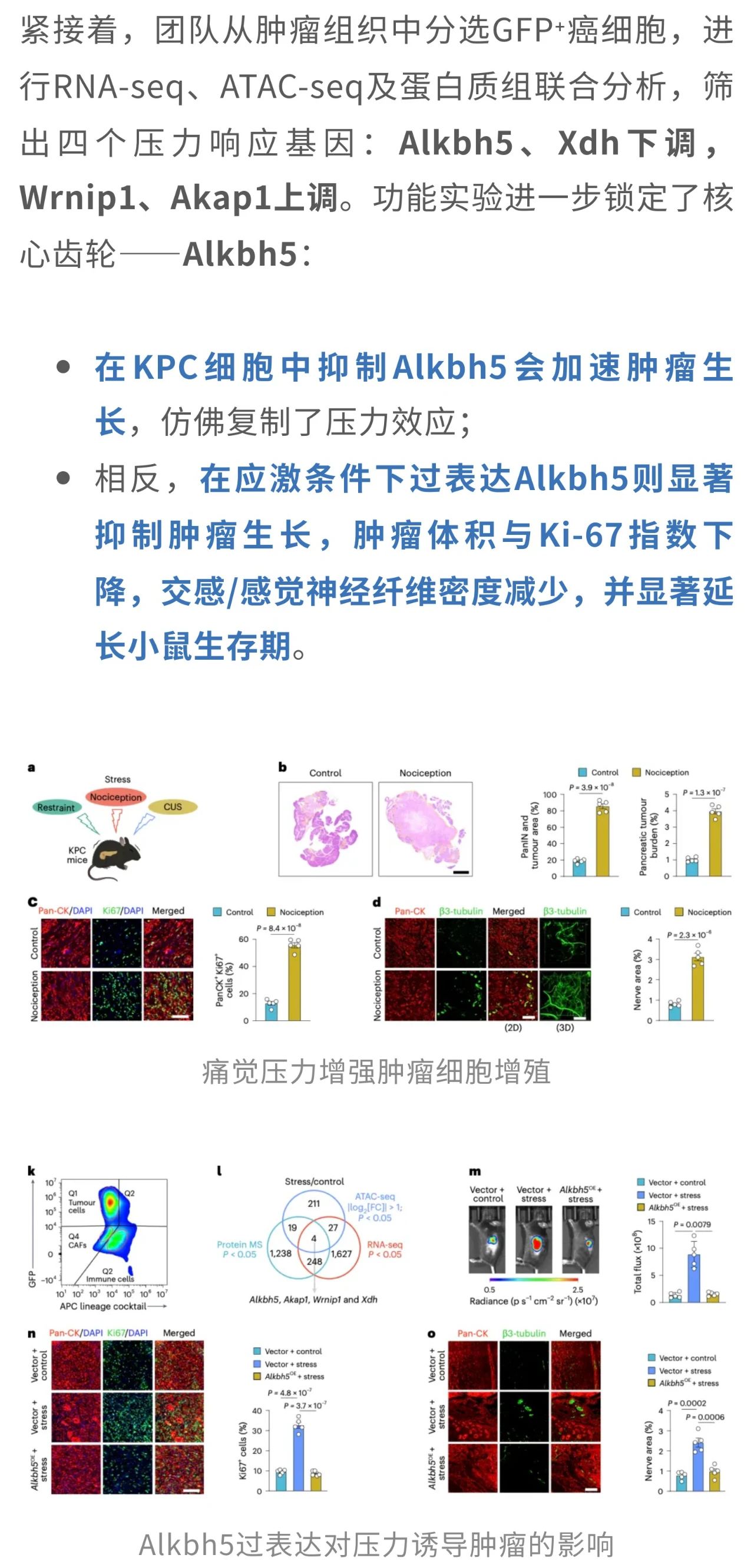
压力来袭,胰腺癌也“疯狂”

结果,三条路径指向同一个结局——病程显著加快:癌前病变和总体肿瘤负荷增多,Ki-67显示增殖活跃;肿瘤周围的交感神经(TH⁺)和感觉神经(Trpv1⁺)纤维也明显“扩容”,提示神经重塑与肿瘤生长相互呼应。
压力如何一步步“关掉”抑癌基因?
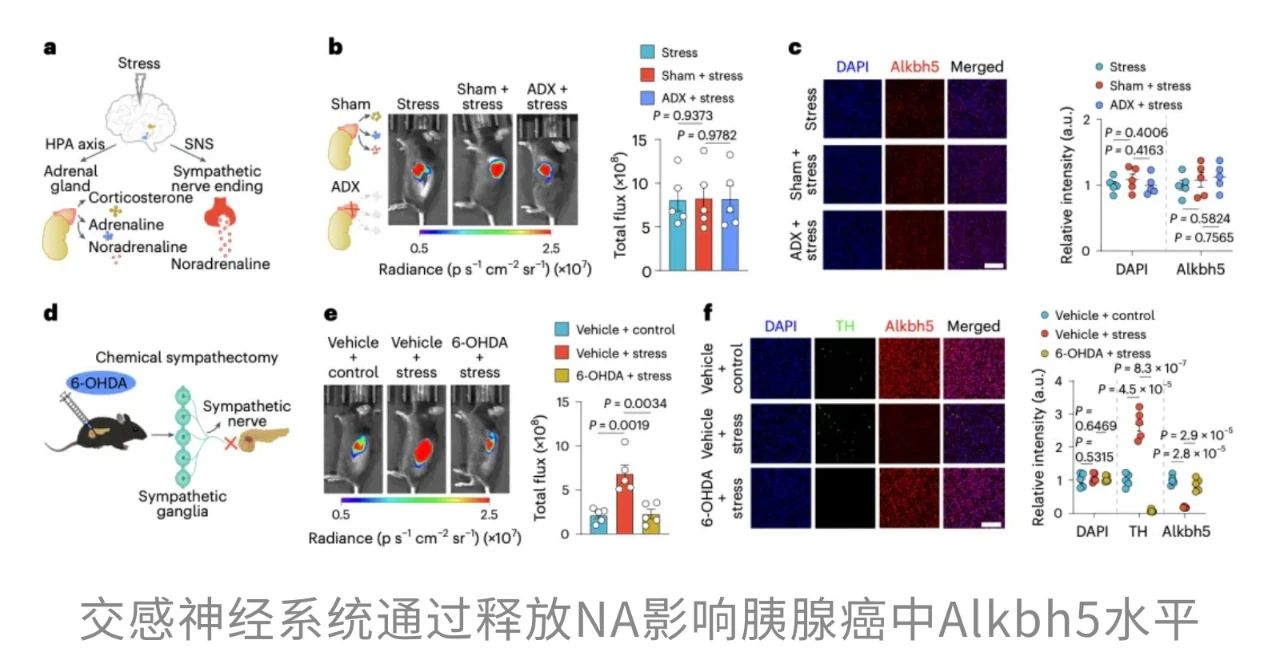
事实上,早有研究提示,压力可能通过两条通路影响癌症的进展:一是下丘脑-垂体-肾上腺轴(HPA轴),二是交感神经系统。但到底谁才是“主谋”?
一开始,研究人员把怀疑的目光投向了HPA轴。他们推测,是压力让小鼠分泌了大量应激激素,比如皮质酮,从而压制了肿瘤抑制因子Alkbh5的表达,进而推动了胰腺癌的进展。为了验证这个假设,研究人员切除了小鼠的肾上腺,阻断皮质酮的产生。
结果却出人意料:即使没有了皮质酮,肿瘤依然疯狂生长,Alkbh5的表达也并未恢复。这说明,幕后真正“操纵”癌症进展的,并不是HPA轴这一路。

这一发现让研究者逐渐厘清了真相:原来,是压力激活了交感神经系统,释放NA,从而压制了Alkbh5,为胰腺癌的扩张“添柴加火”。

而如果让小鼠“强行”过表达Alkbh5,就可以逆转NA带来的促癌效应。也就是说,Alkbh5 是连接压力与癌症的关键节点。
那么,NA是通过什么机制让Alkbh5 被“封口”的呢?
研究进一步揭示,在NA大量释放的情况下,它会与胰腺癌细胞表面的β2肾上腺素受体(ADRB2)结合,启动一系列信号转导反应。这条通路最终会导致组蛋白H3第27位赖氨酸的乙酰化水平(H3K27ac)下降,使Alkbh5基因所在的染色质区域变得更致密、不易被转录,从而抑制其表达。
EVs“断供”,肿瘤“乖了”
看来,RNA去甲基化酶ALKBH5在胰腺癌中扮演着“刹车”角色。一旦这把“刹车”失灵,肿瘤便会加速生长,并主动招募交感与感觉神经进入肿瘤组织。被招来的神经进一步分泌信号分子,反过来刺激肿瘤细胞活性,形成恶性循环。动物实验与患者样本的数据也显示:ALKBH5水平越低,神经浸润越严重,患者生存期也越短。
而这一失衡往往始于精神压力。压力导致NA升高,而NA会显著抑制ALKBH5表达,进而提高胰腺癌细胞RNA的m6A修饰水平。这种表观遗传变化可同时激活多条促癌通路,使癌细胞增殖、迁移能力飙升,并更易与周围神经系统互作。
更深入的实验发现,外泌体(EVs)是肿瘤和神经对话的关键“信使”。缺少ALKBH5的胰腺癌细胞释放的EVs具备强大的促轴突生长能力,而正常细胞的EVs则无此效应。双敲除实验(同时敲除Alkbh5和EVs分泌必需基因Rab27a)进一步证明:如果EVs“出不去”,神经纤维增长、神经浸润以及肿瘤扩张都会同步减弱。这也意味着,ALKBH5缺失引发的神经生长和肿瘤进展依赖于Rab27a介导的EVs释放。
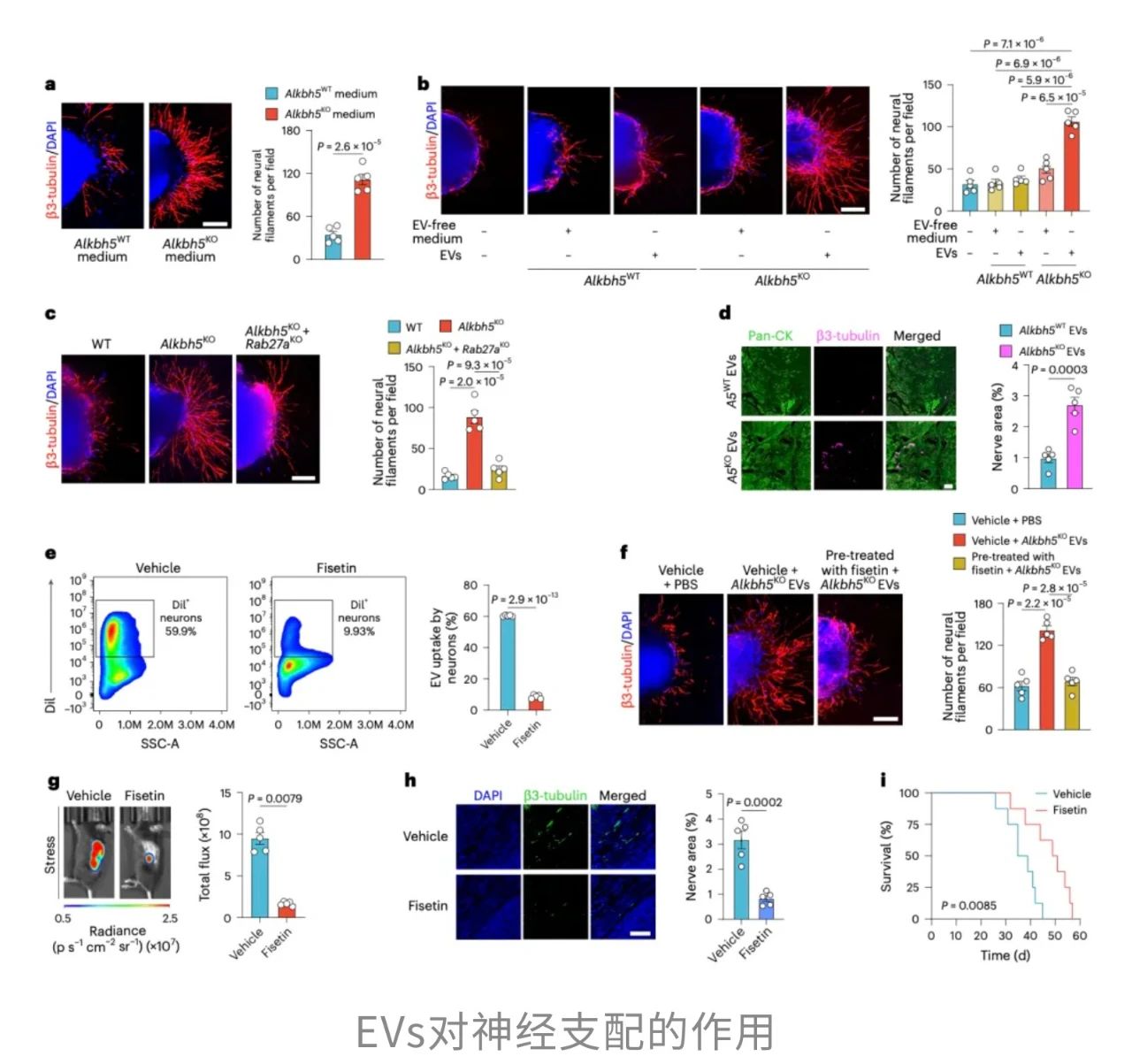
从核心机制上来说,在精神压力驱动下,NA通过抑制ALKBH5降低RNA去甲基化,从而改变肿瘤细胞分泌EVs的组成。这些EVs被神经细胞摄取后,通过m6A修饰的RNA片段“吸附”miRNA,解除其对神经生长相关基因的抑制,促进神经纤维向肿瘤组织生长。神经的异常浸润不仅为肿瘤提供更多生长信号,也通过持续的神经–肿瘤互作,进一步加速胰腺癌的恶性进展。
抗癌新拼图:
菌群、情绪与饮食,缺一不可
当然,压力并不只在“神经–肿瘤”之间架桥。事实上,它对机体的影响远比想象中更广、更深。除了神经系统,压力也会扰乱与免疫、代谢密切相关的肠道微生态。而就在另一项发表于Nature子刊Signal Transduction and Targeted Therapy的研究[2]中,来自大连医科大学的研究团队发现,精神压力同样能通过破坏肠道菌群,间接推动肿瘤的发生与恶化。
具体来说,精神压力会打乱肠道微生态,特别是让本应“坐镇守护”的益生菌——嗜黏蛋白阿克曼菌(简称Akk)显著减少。随着这些关键菌群的衰退,肠道中具有抗炎和调节作用的短链脂肪酸——丁酸的水平也随之下降。这一连锁反应,会促使乳腺癌细胞逐步转向更具侵袭性、更难治疗的癌症“干性”,为肿瘤的发生、转移、耐药乃至复发埋下隐患。

研究团队早在数年前就注意到,心理压力能够显著增强乳腺癌细胞的“干性”,也就是让癌细胞更容易自我更新、更具迁移能力,甚至对治疗产生耐药,成为促使肿瘤复发和恶化的“内因”之一。虽然这一发现引发了学界广泛关注,但其中的关键问题始终悬而未解:压力究竟是如何一步步作用于癌细胞的?中间是否存在某种“信使”或“通道”?
随着对肠道微生态研究的深入,越来越多的证据将压力、肠道菌群与肿瘤联系在了一起。一方面,心理应激会激活神经—内分泌轴,进而改变肠道菌群结构;另一方面,肠道菌群的失衡与肿瘤干性之间也被屡屡观察到相关性。这一切提示研究团队,连接心理状态与肿瘤恶化的“桥梁”,可能就藏在肠道里。

这意味着,没有肠道菌群的参与,压力几乎无法真正“撬动”乳腺癌的进展。
找到了桥梁,接下来就是锁定“关键角色”。研究人员随即将目光转向肠道菌群中是否存在某些关键“节点”——也就是对压力变化高度敏感,同时又可能影响肿瘤行为的核心菌属。

Akk菌其实在近年来的代谢研究中已小有名气,它与宿主的炎症调节、代谢平衡密切相关。

但Akk菌究竟是如何发挥作用的呢?研究进一步聚焦了肠道菌群对宿主代谢的影响。分析显示,慢性压力会显著降低粪便、血清和肿瘤组织中的丁酸水平,而Akk菌补充则能部分恢复粪便中的丁酸含量。不过,Akk菌本身并不直接合成丁酸,它的主要产物是乙酸和丙酸。那么,丁酸究竟从何而来?
而谜底在于“生态协作”。Akk菌能显著提升其他产丁酸菌的数量,比如Anaerostipes hadrus、Clostridium butyricum和Roseburia inulinivorans,从而通过“招贤纳士”的方式间接提高了丁酸的合成水平。

也就是说,哪怕只是调整饮食结构,都可能在一定程度上逆转压力带来的肿瘤进展风险。
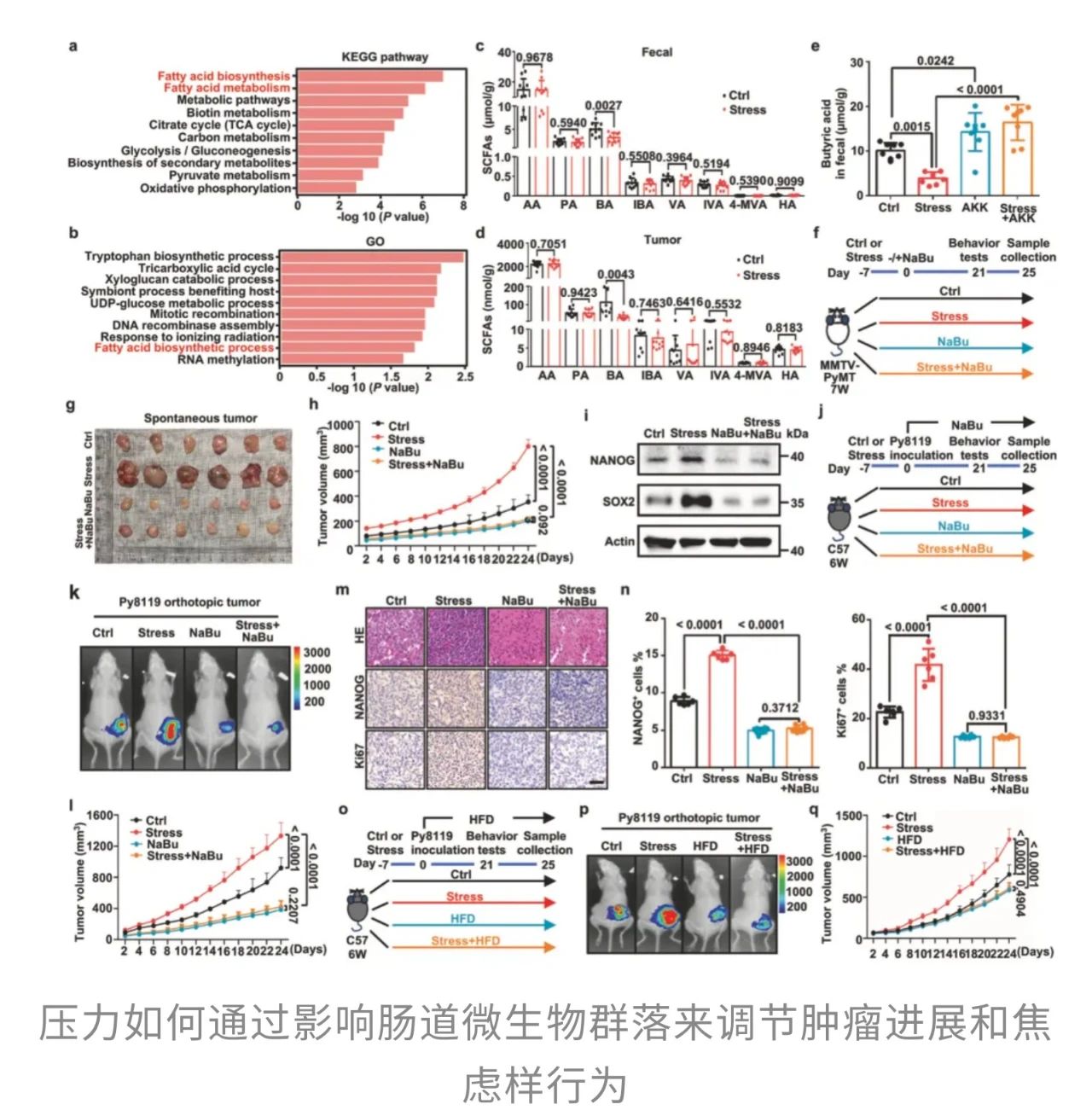
那么,丁酸是如何从分子层面完成“抗癌任务”的呢?研究揭示,它通过抑制组蛋白去乙酰化酶(HDACs)这一关键调控通路,上调了RNA结合蛋白ZFP36的表达。而ZFP36进一步靶向降解Wnt/β-catenin通路的核心调控分子LRP5的mRNA,从而“掐断”了维持干性的信号路径。
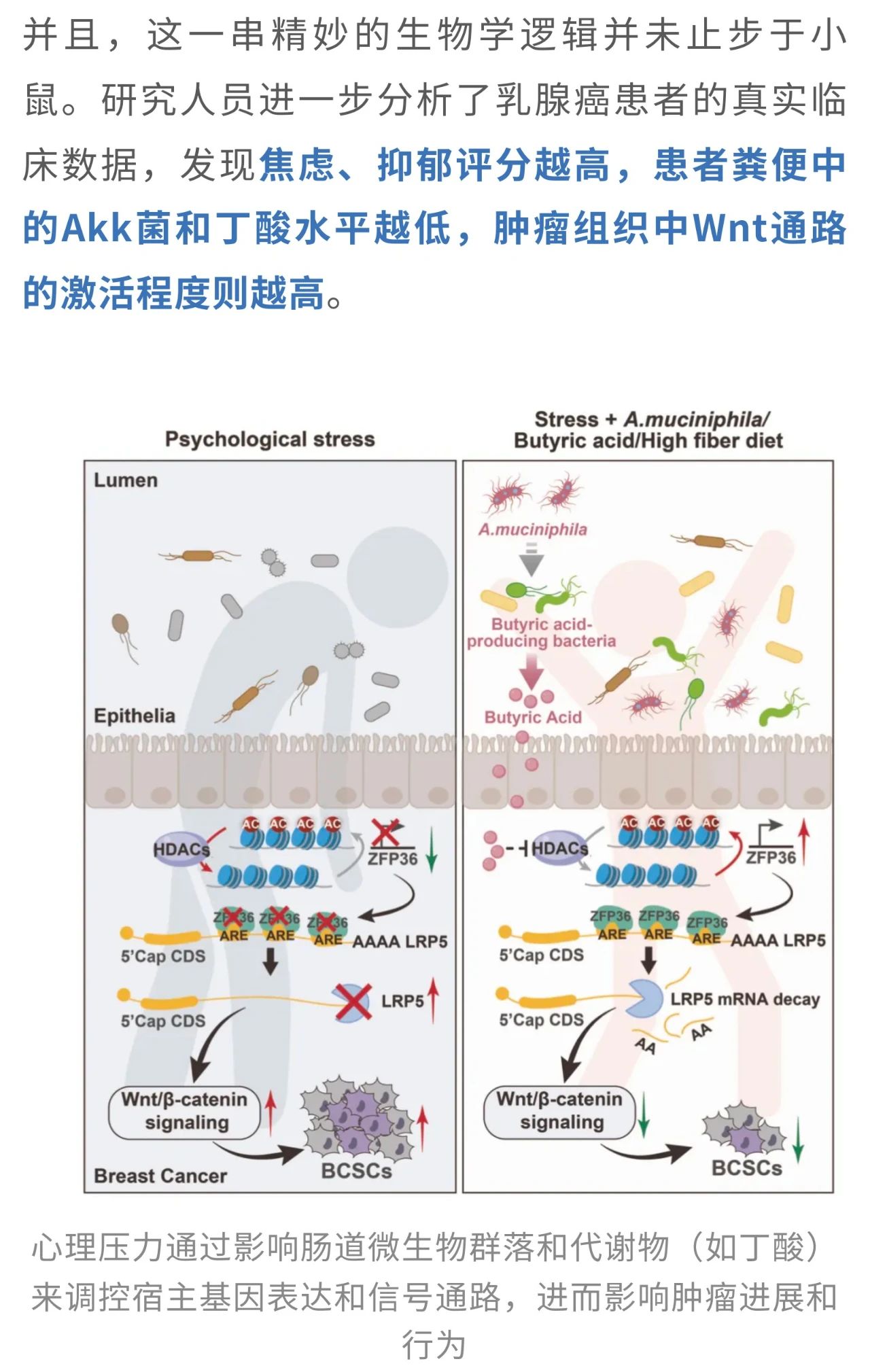
总的来说,这项研究为肿瘤管理提供了新的启发:治疗癌症不仅是“干掉肿瘤”那么简单,或许也该从“安抚肠道”与“疏解心理”开始。
生活就像一场马拉松,我们总是在快节奏中前行。但别忘了,压力就像那个偷偷藏在鞋里的小石子,刚开始可能只是有点不舒服,久了却可能磨出水泡,甚至让人跑不动。是时候放慢脚步,给自己解解压了。也许只是午后的那杯茶,窗外的那阵风,或者是放下手机的那几分钟。让身体和心灵都停下来歇歇。
仍需指出的是,这两项研究主要基于动物模型,在人类中的普适性仍需进一步验证。
参考资料:
[1]hen, Z., Zhou, Y., Xue, C.et al. Psychological stress-induced ALKBH5 deficiency promotes tumour innervation and pancreatic cancer via extracellular vesicle transfer of RNA. Nat Cell Biol 27, 1035–1047(2025). https://doi.org/10.1038/s41556-025-01667-0
[2]Cui, B., Luo, H., He, B.et al. Gut dysbiosis conveys psychological stress to activate LRP5/β-catenin pathway promoting cancer stemness. Sig Transduct Target Ther 10, 79(2025). https://doi.org/10.1038/s41392-025-02159-1
责任编辑 |素心
预览审阅|风铃
外联编辑|方格子/宁宁

















