
植物疾病对人类和环境健康的影响
1974年,作为世界各地第一期《细胞文库》,人们对植物与微生物相互作用的机制知之甚少,但显然需要更好的理解才能有效控制作物疾病。植物疾病流行病自古以来就影响着社会和粮食安全。在许多例子中,由卵菌疫霉菌引起的马铃薯晚疫病导致了19世纪40年代的爱尔兰马铃薯饥荒,导致数百万人移民,从而在美国形成了一个庞大的爱尔兰社区。英国人的茶饮习惯是真菌性锈病流行的结果,这种疾病摧毁了斯里兰卡的咖啡作物,迫使人们转向茶。风传茎锈病会破坏小麦产量,在北美,1903年和1905年以及1950年至1950年期间发生了巨大的粮食损失。尽管自1974年以来取得了许多进展,但作物疾病并没有消失。在过去的5年里,由于Candidatus liberibacter细菌引起的虫媒疾病,佛罗里达州的橙子产量下降了80%以上。可可(一种树木作物,也是巧克力的来源)、咖啡、木薯和香蕉受到真菌、卵菌、细菌和病毒疾病控制不力的影响,这些疾病大大降低了产量,增加了种植成本。20世纪70年代,这些警钟鼓励人们加入新兴的分子-植物-微生物相互作用(MPMI)领域。
2019年,约有200万吨农用化学品用于作物生产,其中47.5%为除草剂,29.5%为杀虫剂,17.5%为杀菌剂。4每年仅在杀菌剂上的支出就超过200亿美元。气候变化加剧了作物生产挑战,包括世界各地病原体生长范围的变化。然而,尽管基因解决方案明显优于化学解决方案,但在许多司法管辖区,基因解决方案仍然存在争议。
MPMI研究人员面临的一个持久挑战是病原体(真菌、细菌、卵菌、病毒或无脊椎动物)和寄主植物物种的多样性。经济学传统上推动资金支持对作物产量影响最大的疾病研究,即使这些疾病不太适合揭示新的生物学见解。早期的MPMI研究还优先考虑了豆科植物和细菌固氮共生体根瘤菌之间的共生相互作用,以及形成冠胆的农杆菌(根瘤菌的近亲)将DNA输送到植物细胞中的机制。这可能是因为20世纪70年代和80年代的分子技术使细菌得以发现,而植物则不然。1982年,在德国比勒费尔德举行的第一次MPMI会议上,几乎所有的演讲都是关于根瘤菌或农杆菌的,六次会议中只有一次是关于细菌病原体假单胞菌、黄单胞菌和欧文氏菌的毒力机制的。没有关于真核病原体或抗病分子机制的会议。
1974~1994年植物免疫
研究进展
在重新发现孟德尔遗传定律后不久,植物抗病性的遗传分析就开始了,有报道称小麦对锈病真菌病原体的抗性是由单一的半显性抗病基因赋予的。抗病性或易感性的表型不仅取决于寄主,还取决于病原体的基因型;小麦锈病菌的一些但不是所有小种都能克服特定的R基因并致病。在对亚麻(Linum usitatissimum)及其锈病菌Melampsora lini相互作用的遗传学研究中。这当然引出了一个问题:为什么病原体会编码一种能够抵抗的产物?这一明显的矛盾现在已经得到解决;病原体Avr基因可能有助于病原体毒力,前提是宿主没有进化出检测它的免疫受体(详见下文)。病原体通常编码并部署到植物细胞中数百种这种毒力因子,通常被称为毒力“影响因子”。然而,如果其中一种被宿主免疫受体识别,通常会激活足够的防御来阻止病原体。病原体需要部署足够的功能冗余的毒力效应子来感染宿主,但宿主只需要检测到一个效应子就可以产生耐药性。在遗传多样的宿主群体中,每个个体都具有不同的检测能力,而频率依赖性的选择限制了病原体的成功,因为在群体中的一种植物上逃避检测的病原体种族可能无法在大多数植物上做到这一点。
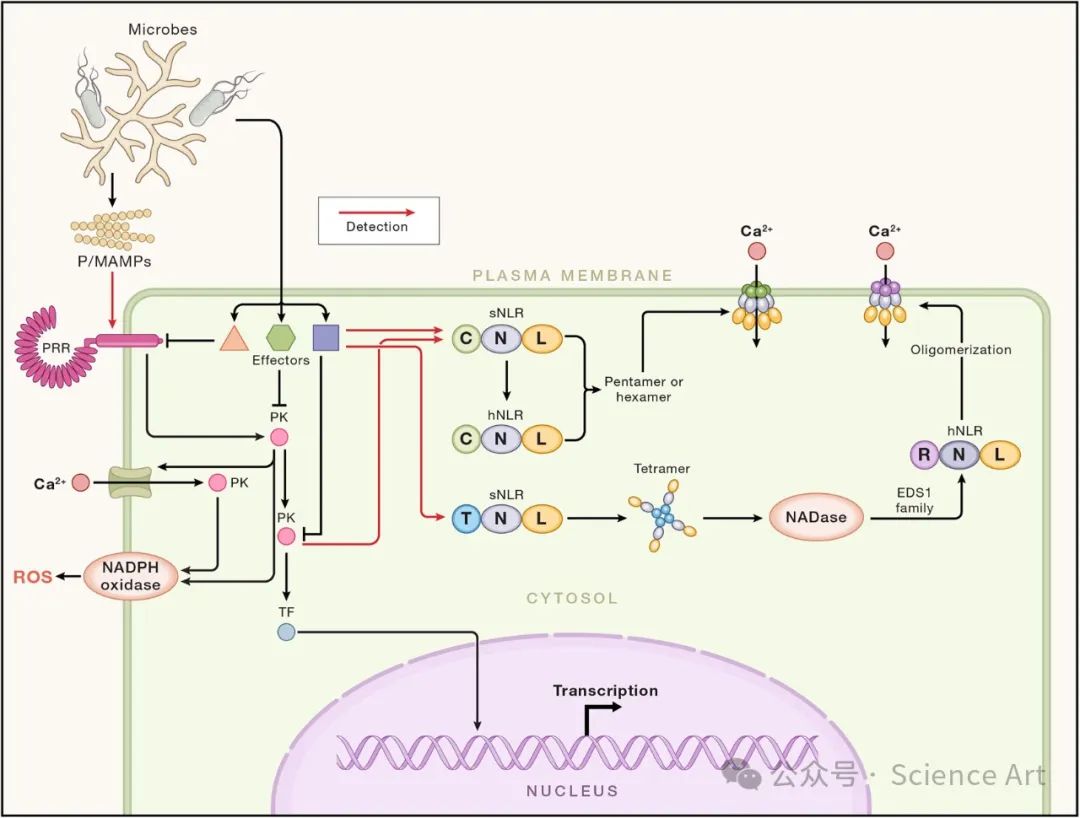
与此同时,另一项早期研究确定了病原体衍生的分子(“诱导子”),这些分子激活防御,并定义了它们激活的一组复杂的植物防御反应。诱导子最初被定义为激活植物抗毒素生物合成的病原体分子,该名称被赋予一组不同的抗微生物次级代谢产物,其中许多来自苯丙氨酸或色氨酸。这激发了对苯丙氨酸裂解酶(PAL)基因及其在各种系统中的诱导作用的研究。值得注意的是,在欧芹的细胞培养物中,疫霉分泌的诱导子导致PAL转录诱导。这些研究最终形成了一篇具有里程碑意义的Cell论文,该论文定义了源自这种转谷氨酰胺酶激发子的最小13个氨基酸的肽(Pep13),其与欧芹细胞培养物中假定的受体的高亲和力结合,以及由此产生的防御反应。除了植物抗毒素的积累外,激发还通过质膜NADPH氧化酶、Ca2+流入、促分裂原活化蛋白激酶和其他蛋白激酶的激活、细胞壁强化和防御相关基因触发活性氧(ROS)的产生激活。这种针对微生物模式识别的防御反应被称为模式触发免疫(PTI)。
PTI的概念框架是由已故的Charles Janeway,Jr.开创的,他认为相对保守的病原体模式,如鞭毛蛋白或脂多糖,是特定的后生动物免疫兴奋剂。他指出,这可能是“免疫学肮脏的小秘密”的基础,即对注射抗原的免疫反应通常需要被称为“佐剂”的细菌产物的混合物。Polly Matzinger提出了一个对比但并非相互排斥的概念,她认为自我与非自我的区分涉及对“受损”宿主成分的识别,她称之为“危险信号”。我们现在接受植物细胞衍生的修饰自我成分和活性氧等通用危险信号在植物免疫系统中也起着关键作用。早期整合后生动物和植物免疫系统思维的尝试有助于推动MPMI领域的发展。
第三个平行的线索涉及突变表型的研究,在这种突变表型中,防御似乎在明显没有任何病原体的情况下被激活。种病变模拟突变体,有时被称为“类植物”(即使没有受到攻击也能激活防御),可能是由于防御负调控因子的隐性突变,也可能是由于半显性突变,其中免疫受体等位基因通过携带免疫受体基因多个同源基因的基因座的突变或不平等交叉而出现,该基因座具有组成活性。后者的一个经典早期例子是玉米Rp1基因座的Rp1-D21等位基因,该等位基因赋予对锈病病原体Pucci nia sorghi的抗性。
我们目前对MPMI和植物免疫的理解在1974年是不可想象的。基因对基因模型是使用20世纪80年代出现的各种方法开始基因分离提供概念框架的关键。对新兴模型系统的关注导致免疫受体基因和效应基因被克隆,如下所述。大多数R基因编码核苷酸结合的富含亮氨酸重复序列(NLR)蛋白的发现提供了一个关键的进展,如下所述。相比之下,效应基因编码具有不同生化功能的蛋白质。定义了NLR和细胞表面免疫受体的直接或间接识别机制,以及由与细胞表面受体结合的微生物配体启动的防御机制和细胞内NLR受体激活的相互作用。基因组学加速了植物免疫受体库和病原体效应互补物的发现和分析。重要的进展伴随着有影响力的重新审视。该领域已经变得过于广阔,无法全面描述每一项发现,因此我们试图强调过去50年来我们领域最重要的概念进步。重要进展的时间表如图2所示。

农杆菌、植物肿瘤和肿瘤诱导(TI)质粒作为毒力机器和研究与工程工具
革兰氏阴性土壤细菌根癌农杆菌是如何引起植物疾病并使基因转移到植物染色体DNA中的,这提供了一个引人注目的例子,说明好奇心驱动的科学如何使一项改变游戏规则的技术成为可能。Chilton等人在《细胞》杂志上发表的一篇具有里程碑意义的论文中表明,农杆菌的部分肿瘤诱导(Ti)质粒被整合到宿主基因组DNA中。转移的DNA(T-DNA)携带编码酶的基因,这些酶参与植物生长激素的合成和农杆菌可以用作碳和氮源的固醇(氨基酸-糖偶联物)的合成。了解T-DNA从农杆菌转移到植物是MPMI领域的早期胜利,也是支撑作物基因改造的开创性成就,并为研究植物基因功能创造了不可或缺的工具。T-DNA转移过程由参与细菌结合的4型分泌系统进化而来,T-DNA在随机位置整合到宿主DNA中,这一发现使参考植物拟南芥中能够产生饱和突变体集合。将感兴趣的基因传递到易感植物(如本氏烟草)叶片中的农杆菌菌株的渗透导致瞬时基因表达,这大大有助于研究防御机制、蛋白质-蛋白质相互作用和植物免疫受体结构生物学的蛋白质制备。
“拟南芥没有病原体!”以及细菌效应组学的早期
基因对基因模型及其对病原体中“可识别性”基因的反直觉预测,促使人们寻找无毒性(Avr)基因。Klement的关键观察结果表明,假单胞菌的所有致病菌株都可以在烟草叶片的接种部位引发快速的“超敏细胞死亡反应”(HR),这使他提出类似的分子过程可以调节毒力和耐药性。20世纪70年代和80年代开发的重组DNA技术彻底改变了这一领域。一个关键的进展是开发了用于研究根瘤菌生物学的宽宿主范围克隆载体,并认识到这些载体也可用于研究假单胞菌和农杆菌基因。关键的概念见解是,Flor在真菌病原体中遗传定义的显性Avr基因也可以通过在由抗性病原体种族的DNA制成的克隆库中鉴定从致病菌中分离出来,这些克隆在递送到毒力(非HR诱导)假单胞菌菌株中后赋予HR诱导表型的增益。
对辣椒致病的euvesicatoria菌株是第一个被证明是完全毒力和适应性所必需的效应物。这表明,相应的辣椒R基因Bs2可能是“可持久的”,因为AvrBs2功能的丧失会损害病原体的适应性。重要的是,可识别性所需的AvrBs2氨基酸也是病毒产生所需的。辣椒Bs2确实在转基因中对mato44具有很强的抗性,并能抵御黄单胞菌,这是一种在炎热潮湿环境中的严重病原体。这些和类似的发现解决了病原体编码基因的矛盾,这些基因对一些植物宿主具有很大的适应性成本;这些基因编码同一宿主或其他无法识别它们的宿主物种的其他基因型的毒力功能。随后,几篇论文证明了Avr蛋白在宿主细胞内被识别。这表明一定存在递送机制,并且R基因编码的蛋白可能是细胞内的。最后,来自一个植物宿主病原体的不相关基因可以被第二种植物宿主识别为Avr基因,这一事实提供了第一条线索,即“基因-基因”相互作用可能导致宿主范围限制和“非宿主抗性”。同时,转座子突变揭示了假单胞菌突变体失去了在烟草上引起HR的能力。与同时在动物的细菌病原体中也有发现,这些集群的测序确定了广泛分布在动植物革兰氏阴性病原体中的III型分泌系统。III型分泌底物,包括Avr蛋白,被重新命名为“影响因子”。许多细菌效应子随后被证明编码酶,这些酶修饰有助于免疫反应的宿主蛋白靶点。在过去的30年里,对效应器功能和进化的剖析,以及由此产生的宿主细胞靶标的定义,照亮了这一领域。
当研究人员在20世纪80年代中期集中研究模式植物拟南芥时,MPMI研究的进展加快了(图3)。在参考拟南芥基因型Columbia(Col-0)上鉴定出两个引起疾病的丁香假单胞菌菌株(DC3000,番茄的病原体,和ES4326,Brassicas的病原体)。一旦克隆的Avr基因被鉴定(见上文),它们就可以偶联到DC3000或ES4326中,并测试所得菌株在不同拟南芥基因型上的可识别性(无毒性)。
这些发现使MPMI的下一个重大进展得以实现,即鉴定编码细胞内先天免疫受体的抗病性R基因。对拟南芥的关注,凭借其快速扩展的基因组分析和基于图谱的克隆资源,使人们能够鉴定出检测假单胞菌ef的多种免疫受体。在这一时期,利用拟南芥材料对特定Hpa小种的反应中的广泛自然变异来促进一系列RPP抗性基因的分离。
虽然烟草、番茄和亚麻比拟南芥更不适合基于图谱的克隆,但从番茄中克隆的第一个R基因的基因是Pto。Pto是一种蛋白激酶,可识别假单胞菌效应子AvrTo。识别烟草花叶病毒的烟草N基因、赋予对真菌黄腐枝孢抗性的番茄Cf-9和识别亚麻锈病特定小种的亚麻锈病抗性基因等位基因L6都是通过用玉米转座子激活子或其非自主衍生物解离转化携带这些基因的植物而克隆的。对产生的植物群体进行失去免疫受体功能的突变体筛选,并鉴定和分析转座子插入位点,从而能够分离出相应的R基因。
通过比较上述R基因编码的蛋白质序列,可以确定NLR蛋白质的保守特征,这些特征今天被认为是该超家族的特征。除Pto外,所有蛋白质都携带富含亮氨酸的重复序列(LRR)。Cf-9和Xa21是具有细胞外LRR的细胞表面受体,具有(在水稻中用于黄单胞菌抗性的Xa21)或不具有(Cf-9)细胞内蛋白激酶结构域。其他编码具有核苷酸结合(NB)结构域和C末端LRR的模块化蛋白,其N末端携带Toll/白细胞介素-1/抗性蛋白(TIR)结构域(对于N、L6、RPP1、RPP5、RPS4和RRS1)或卷曲线圈(CC)结构域。细胞内免疫受体类似于哺乳动物受体,如NOD1、NOD2和NLRC,这类蛋白质被命名为NLRs(用于NOD样受体或核苷酸结合的富含亮氨酸的重复受体)。类似的模块化结构在凋亡蛋白(APAF1和CED4)、真菌体细胞相容性蛋白60和与细菌对噬菌体的耐药性有关的蛋白中也很明显。细胞内受体检测病原体时启动的免疫机制被称为“效应触发免疫”。这些观察结果为我们目前对植物免疫的理解奠定了基础,植物免疫是基于细胞表面受体、细胞内受体或两者检测病原体配体时启动的过程。
表面受体与模式三重免疫(PTI)
许多病原体衍生的微生物或病原体相关分子模式(MAMPS或PAMPS)通过细胞表面模式识别受体(PRRs)激活模式触发免疫(PTI),如在动物先天免疫中,通常通过识别相同的P/MAMPS。细菌鞭毛蛋白、假单胞菌的Pep13、真菌聚合物几丁质(主要是其部分水解产物为N-乙酰葡糖胺的低聚物)、植物细胞壁的低聚半乳糖醛酸(一种损伤相关分子模式,简称DAMP)和许多其他配体在感知它们的细胞中引发类似的反应。其中包括诱导类似的基因集对每个配体作出反应,通过NADPH氧化酶产生ROS和包括至少两组促分裂原活化蛋白激酶MAPKs的多种蛋白激酶的活化。尽管在几个实验室进行了明确的生物化学研究,但在Boller实验室使用遗传学鉴定拟南芥鞭毛蛋白传感2(FLS2)基因之前,没有鉴定出PAMP/MAMP受体。FLS2是编码对细菌鞭毛蛋白或其截短的替代物flg22作出反应的能力的遗传基因座。FLS2编码植物细胞表面的LRR蛋白激酶受体。 FLS2的功能需要BAK1共受体,另一种最初定义为BRI1功能所需的LRR激酶,一种检测植物激素油菜素内酯并使其产生反应的LRR酶。番茄Cf-9受体样蛋白在识别黄曲霉质外质蛋白Avr9(一种具有3个二硫键的28个氨基酸的紧密折叠分泌胱氨酸结肽)后,也激活一组PTI样反应,并需要BAK1发挥作用。Avr9是第一个被定义的真菌无毒蛋白。Cf-9能够在烟草和本氏N.benthamiana中感知Avr9,有助于通过表达谱进行详细研究,以揭示诱导的基因。值得注意的是,这些分析揭示了ACIK1,它是受体样细胞质激酶(RLCK)家族许多成员中第一个与表面受体介导的免疫有关的成员。拟南芥BIK1是研究最多的RLCK,其靶标的确定继续揭示了植物防御机制的新成分。产生ROS的NADPH氧化酶的激活需要RLCK和钙依赖性蛋白激酶的协同作用,后者可能通过钙通道激活后的Ca2+内流激活。在许多其他靶标中,RLCKs激活钙通道,钙通道在植物防御中起着至关重要的作用。PTI信号传导具有由各种细胞因子介导的扩增环,这些细胞因子被检测PTI启动时诱导或释放的植物来源肽的PRR样蛋白识别。其他LRR激酶、RLCKs、钙依赖性蛋白激酶和蛋白磷酸酶用于减弱或调节PTI,使其强度和持续时间能够精细微调。
许多额外的细胞外受体已被定义为识别细菌、真菌或其他配体。大多数表达LRR外结构域,尽管在PRR中发现了其他几个外结构域。一个持久的悖论是,在检测到含有N-乙酰葡糖胺的低聚物或去衍生物时,激活防御的赖氨酸受体激酶的同源物也可以激活共生发育程序。
护卫、护卫和诱饵——如何最大限度地利用有限的受体
Pto的分离提供了一个难题,即蛋白激酶是如何提供感知能力的?这在一篇具有里程碑意义的Cell论文中得到了解决,该论文表明Pto功能(以及连接的Pto-paralog Fen的功能,赋予对杀虫剂倍硫磷的敏感性)需要细胞内NLR免疫受体Prf.。因此,在这种情况下,进化倾向于由NLR监测的蛋白质的复制和分化,而不是NLR的进化,以感知通过Pto或Fen作用的独立配体。这促使提出了“保卫假说”。
相反,原效应子识别病原体效应子对宿主蛋白的修饰。间接受体介导的对具有重要防御功能的修饰自身分子的识别,因此可能被病原体毒力效应子重复靶向,可以扩展有限的种系编码免疫受体库,减少仅通过NLR库进化许多独立识别特异性的需要。
许多NLR通过保护宿主成分发挥作用。拟南芥RPS2和RPM1都监测RIN4蛋白的状态,RIN4蛋白被七个不相关的细菌III型效应子靶向。RPS2在AvrRpt2蛋白酶切割RIN4时激活免疫,RPM1在检测到RIN4的AvrB-或AvrRpm1介导的翻译后修饰后激活免疫,这些修饰最终干扰RIN4磷酸化开关状态。RPS5监测RLCK PBS1的状态;当PBS1被AvrPhB蛋白酶切割时,RPS5激活免疫。ZAR1通过中间假激酶如ZED1或RKS1监测几种RLCK样蛋白的状态。ZAR1是为数不多的在远缘植物物种中显示同源物的NLR之一,这一点非常引人注目。重要的是,一些哺乳动物的NLR也可能对病原体效应的作用产生反应。如果保护成分发生突变,其结果可能是由于NLR去表达而产生的自身免疫。
并非所有基因定义的R基因都编码NLR蛋白。一类有趣且新颖的R基因编码蛋白激酶融合蛋白,包括串联蛋白激酶或与其他结构域融合的蛋白激酶。在小麦和大麦中,几个R基因编码包括功能激酶和假激酶的串联激酶基因。可以想象,这些多态性激酶可能由相对保守的NLR保护,类似于上文详述的Pto-Prf或RKS1-ZAR1。
保护宿主靶点的受体也存在于细胞表面。例如,与Cf-9一样赋予黄曲霉抗性的番茄细胞表面受体Cf-2需要分泌的半胱氨酸蛋白酶Rcr3来赋予抗病性。Rcr3与黄曲霉质外体效应器Avr2结合并被其抑制(其也抑制其他分泌的宿主半胱氨酸蛋白酶)。因此,Cf-2保护Rcr3,并在Avr2抑制它时激活防御。Rcr3家族半胱氨酸蛋白酶有助于抗病性,为其被病原体编码的抑制剂靶向提供了进化原理。
所有被监测的蛋白质都是防御成分吗?诱饵模型指出,宿主可以进化出等位基因或旁系基因,它们本身不再提供不可或缺的防御功能,而是充当真实病原体靶标的模拟物。
免疫受体的结构生物学——抗性体的揭示
在过去的五年里,由于冷冻电镜方法对结构生物学的改进,在理解NLR蛋白机制方面取得了惊人的进展(图4)。在大多数例子中,NLR蛋白的NB结构域以非活性状态结合ADP,在识别病原体效应器后,构象变化使ADP能够交换为ATP。当与ATP结合时,NB结构域可以相互结合,驱动寡聚物的形成,从而诱导RPP1与ATR1结合。
拟南芥RPP1编码TIR-NLR,其直接识别Hpa效应物拟南芥识别1(ATR1)。RPP1在不同的拟南芥材料之间表现出广泛的等位基因多样性,ATR1在Hpa小种之间表现出等位基因的多样性。每个RPP1等位基因赋予对携带同源ATR1等位基因的病原体小种子集的识别。RPP1变体对特定ATR1变体的识别涉及直接的物理关联。结合ATR1后,RPP1低聚形成四聚体。这种构象变化将蛋白质的N-端TIR结构域聚集在一起,从而激活TIR结构中的固有NA-Dase活性,该活性将NAD+水解成小信号分子,这些小信号分子被EDS1/PAD4或EDS1/SAG101异二聚体检测到。Roq1,一种识别黄单胞菌效应物XopQ的
N.benthamiana TIR-NLR,也形成激活其TIR结构域NADase活性的四聚体,这表明激活的TIR-NLRs的一般模型。
ZAR1识别作用于PTI或其诱饵所需的RLCK的细菌效应蛋白的活性。一种这样的效应物是由油菜黄单胞菌产生的AvrAC,它是芸苔属成员黑腐病的病因。AvrAC ur-dylylylates[向包括BIK1和PBL2的RLCK添加尿苷单磷酸基团(UMP)],从而使它们失活并损害PTI。ZAR1与几种假激酶中的一种组成性地形成异二聚体,例如RKS1。AvrAC对PBL2的尿苷化形成PBL2UMP,其与结合ZAR1的RKS1结合。ZAR1-RKS1-PBL2UMP复合物的形成驱动ZAR1的构象变化,导致其ADP交换为ATP,并将复合物低聚为五聚体。五聚体采用漏斗形状,在质膜中产生阳离子通道,使Ca2+内流。Ca2+浓度升高引发的信号传导诱导ETI重要基因的表达,并可导致细胞死亡。小麦Sr35在直接识别AvrSr35后,也低聚成具有类似于低聚ZAR1.95的N-末端的五聚体。
接下来会发生什么?感知和防御之间的信号传导成分
篇幅有限,中间部分未翻译。。。
悬而未决的问题和未来之路
在这篇评论中,我们强调了免疫受体识别依赖性耐药性。尽管取得了令人瞩目的进展,但仍有许多悬而未决的问题。其他人可能会列出不同的清单,但我们在这里定义了一些我们希望在未来20年内解决的问题。
我们如何提高识别每个公认效应基因的R基因的能力,反之亦然?最近的一份预印本表明了一种途径。阿尔法折叠多聚体与基因组学相结合无疑会有所帮助。EDS1杂二聚体复合物的小分子配体如何驱动选择性ADR1和NRG1的募集和激活?不同的含有EDS1的信号体是否定位于不同的亚细胞区室并在其中发挥作用?我们需要更好地了解信号成分的亚细胞位置,特别是辅助NLR的亚细胞定位。当蛋白质看起来如此相似时,ADR1激活如何主要控制转录反应,NRG1如何主要控制HR?ADR1或NRG1产生的Ca2+通道是如何激活转录的?这是否涉及钙依赖性转录因子,如CBP60或CAMTA家族?ROS、DAMP和其他信号传导的组合控制着感染细胞附近细胞的非自主反应,在感染细胞中辅助性NLR激活的下游是否存在NLR诱导级联。有更多的辅助NLR吗?单子叶植物中有哪些辅助NLR?TIR结构域蛋白和EDS1同源物在单子叶植物中的功能是什么?在拟南芥中,功能性的少数(许多)RPW8旁系同源物是如何对白粉菌抗性做出贡献的?RPW8与hNLRs NRG1和ADR1的N末端结构域的同源性有什么意义?在许多研究中,HR被用作防御激活的替代品,但关于抵抗机制如何阻止病原体增殖,我们还有很多需要了解。用拟南芥RPP13 CNL的实验表明,通过卵菌、细菌或病毒病原体递送ATR13效应蛋白导致病原体抑制。然而,HR仅在卵菌和细菌病原体中观察到,而在病毒病原体中没有观察到。一些病毒抗性基因表现出“极端抗性”,即病毒复制在没有HR的情况下被抑制,而另一些则允许更多的病毒复制,并在病毒复制停止前有HR;为什么?考虑到表面受体和细胞内受体启动的免疫相互增强的要求,单独使用ETI病毒耐药性是如何阻止病原体的?病毒ETI是否招募了RNA沉默机制来阻止病毒RNA的积累?关于毒力和抗性的细胞生物学,特别是叶绿体和其他细胞器在叶片抗性中的作用,还有很多需要了解。芽和根的免疫反应有何不同?免疫系统如何与与共生或共生微生物密切接触的植物组织达成和解,微生物组和非生物胁迫如何与免疫系统功能对接?MPMI领域的进展没有减缓的迹象。未来几年将看到更多免疫受体的结构生物学和基于AI的蛋白质/蛋白质相互作用预测,与基因组学相结合,极大地丰富了我们对植物如何抵抗疾病以及病原体如何绕过宿主免疫反应的理解。我们设想对NLRs进行蛋白质工程,以扩大对新型效应蛋白的识别。

















