摘要:
2025年5月29日,公众号的BioPLUS发布文章《为什么In Vivo CAR-T,最近的风吹得那么凶猛?》文章指出,体内(in vivo) CAR-T可将CAR基因直接递送至患者体内T细胞,实现“原位重编程”。
对于一个药物而言,笔者还是希望知道“它”是从哪儿来的,“它”会到哪里去。参考了BioPLUS的文章后,笔者选择了几个分析标的——Capstan Therapeutics、EsoBiotec和几个中国生物药企。考虑到不想被国内药企联系删文章,还是忍痛割爱地仅分析Capstan Therapeutics比较好。首先笔者的观点是,mRNA技术的的成熟,尤其是LNP递送系统的成熟,有利于In vivo CAR-T的发展。
药企分析
细数LNP、mRNA和CAR-T技术的发展历程,事实上LNP和mRNA的开发时间更早,CAR-T技术的开发时间更晚,虽然CAR-T细胞疗法投入临床应用的时间早于LNP和mRNA——有些反直觉,但可以理解。这一点在Capstan Therapeutics官网里已经说明。
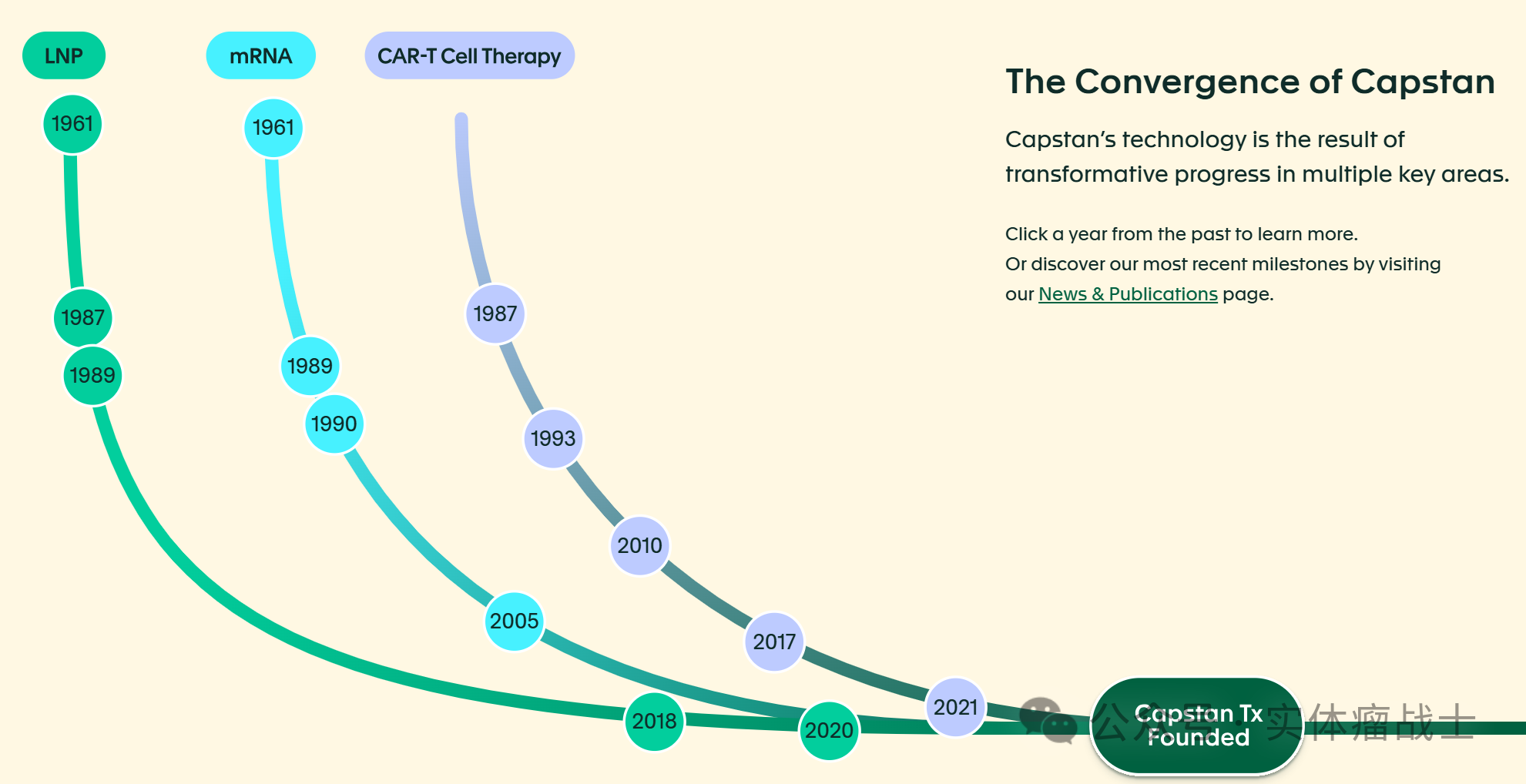
先聊Capstan
2022年,Capstan Therapeutics官宣其获得五家制药巨头,使用mRNA制造CAR-T细胞。不过目前Capstan Therapeutics的投资人更土豪,其得了强生、辉瑞、奥博资本(全球最大的生物医疗基金)等,共计16家药企及资本的投入。

- PROGRAM LIST -
创始人
Capstan Therapeutics的创始人还是很有意思的,几乎每个科学创始人都值得说一说。
Drew Weissman
在2023年获得诺贝尔奖,长期专注于RNA和先天免疫系统生物学的研究。
Carl H. June
宾夕法尼亚大学佩雷尔曼医学院Richard W. Vague免疫治疗教授、细胞免疫治疗中心主任和帕克癌症免疫治疗研究所所长。他是CART细胞治疗领域的先驱,并领导着一个研究实验室,研究与免疫耐受和癌症和慢性感染的过继免疫治疗相关的各种淋巴细胞活化机制。
Bruce Levine
宾夕法尼亚大学佩雷尔曼医学院病理学和实验室医学系临床细胞和疫苗生产设施 (CVPF) 以及艾布拉姆森癌症中心的创始主任。Levine 是CART细胞疗法领域的先驱,包括首次使用慢病毒载体、首次输注基因编辑细胞以及首次使用慢病毒修饰的细胞治疗癌症。
Hamideh Parhiz
宾夕法尼亚大学佩雷尔曼医学院系统药理学和转化治疗学系的助理教授,也是宾夕法尼亚大学佩雷尔曼医学院宾夕法尼亚大学RNA创新研究所靶向核心的联合主任,她领导靶向 LNP 递送计划。她的专长是开发新型核酸递送系统,包括用于各种非疫苗应用(如急性炎症、纤维化、血液基因疾病和癌症)的新一代靶向 mRNA-LNP 疗法。Hamideh在设计高效靶向LNP-mRNA平台方面的工作和专利是Capstan成立的一部分。
Ellen Puré
研究重点是炎症和纤维化的细胞和分子基础,她的实验室为我们理解基质细胞和细胞外基质重塑在组织纤维化和癌症风险、发生、进展和转移中的作用做出了开创性的贡献。
Jonathan A. Epstein
教授、宾夕法尼亚大学卫生系统临时执行副校长和宾夕法尼亚大学佩雷尔曼医学院院长。他还担任宾夕法尼亚大学卫生系统的高级副总裁兼首席科学官。Epstein的研究重点是阐明心血管发育的分子机制及其对理解和治疗人类疾病的影响。他的团队一直处于利用先天性心脏病动物模型来确定心脏形态发生所需的遗传和分子途径的最前沿,这对儿科和成人心血管疾病具有影响。
Steven M. Albelda
医学教授、胸部肿瘤学研究实验室主任和肺癌转化卓越中心的联合主任。在过去的22年里,Albelda 博士领导了一个由NCI资助的项目,旨在开发针对胸部癌症的免疫基因疗法,从而为间皮瘤和肺癌患者开展了一系列1期和2期临床试验。该实验室最近感兴趣的主要领域是增强抗肿瘤免疫作用、过继性T细胞转移以及肿瘤微环境的表征和调节。
- PROGRAM LIST -
递送平台
核心平台技术涉及专有的tLNP递送载体,该载体由与重组蛋白结合剂(如单克隆抗体)偶联的tLNP组成,旨在递送RNA有效载荷,包括mRNA或基因编辑工具,能够在体内对特定细胞类型进行重编程。即LNP是汽车,结合部分是司机,有效载荷为乘客。
脂质纳米颗粒是一种非病毒系统,在临床前模型中证明具有快速生物降解能力,具有重新给药的能力。
结合部分(例如抗体或抗体片段)偶联到纳米颗粒表面,产生tLNP,以便优先将有效载荷递送至特定细胞类型。
编码嵌合抗原受体(CAR)、基因编辑技术或其他治疗性蛋白质的RNA有效载荷,实现对能够在体内对特定细胞类型进行重编程。
- PROGRAM LIST -
耗竭异常B细胞
- PROGRAM LIST -
产品起效流
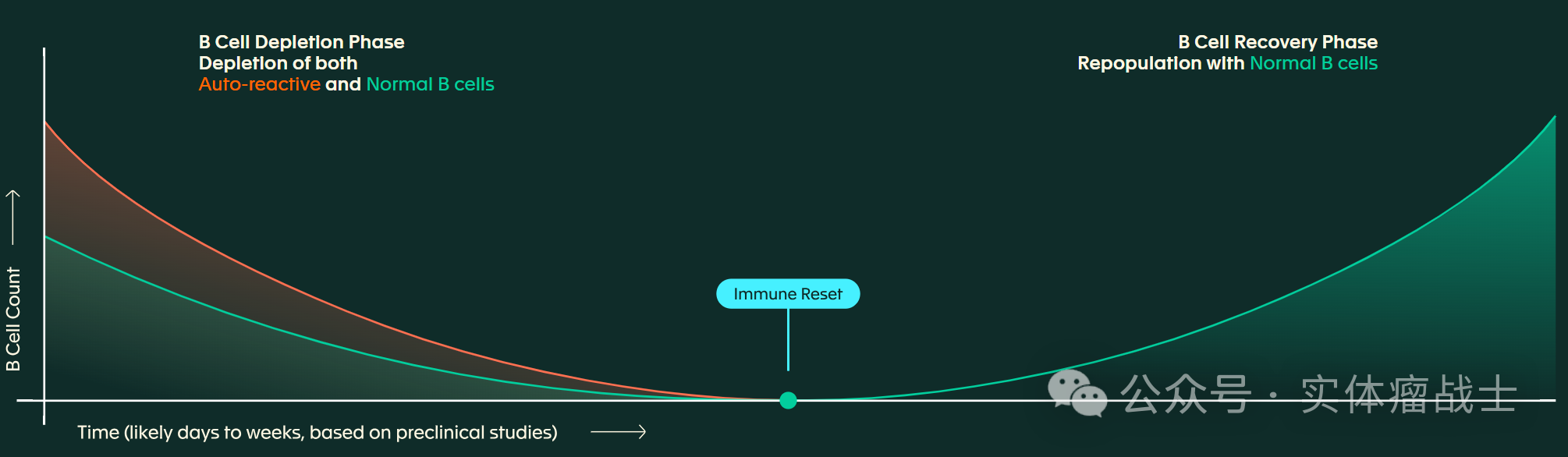
CPTX2309是一种靶向CD8的脂质纳米颗粒(tLNP),由偶联到LNP表面的CD8靶向抗体组成,封装了编码与CD19(B 细胞上表达的细胞表面受体)结合的CAR的mRNA。静脉内给药后,CD8靶向LNP驱动CD19 CAR mRNA优先递送至表达CD8的T细胞,从而在体内有效地改造CAR-T细胞。
体内工程化的抗CD19 CAR-T细胞可迁移至血液和组织中,并迅速清除表达CD19细胞表面的自身反应性B细胞和正常B细胞。
这种对血液和组织中B细胞的深度清除可诱导"免疫重置"。
由于CPTX2309递送的是mRNA有效载荷,其生成的体内工程化CAR-T细胞具有天然瞬时性,可将CAR-T细胞的存在时间限制在数天内。
当CAR-T细胞清除后,血液和组织中会开始重新生成初始健康B细胞,从而在数天至数周内实现"免疫重置"。
- PROGRAM LIST -
产品优势
安全性
瞬时表达的RNA有效载荷可以提高安全性,同时仍能产生持久的效果
生产与给药便捷性
可扩展的技术,消除了离体细胞疗法所需的复杂制造工艺;现成的(无细胞或病毒元件),这意味着患者没有静脉到静脉的等待期
剂量可调
可调剂量,以根据疾病适应症达到所需的安全性和有效性标准
无需严格清淋
不需要患者进行严格的淋巴细胞清除预处理;
- PROGRAM LIST -
应用
体内生成 CAR-T 细胞的方法不仅限于自身免疫性疾病,还可能在肿瘤学和纤维化领域得到应用。
技术分析
tLNP分析
靶向T细胞的脂质纳米颗粒(tLNP)的实验结果,该颗粒专为向T细胞递送基因编辑(GE)有效载荷而设计,其潜在应用包括下一代免疫疗法。由创新型脂质纳米颗粒与重组蛋白结合体偶联而成,旨在实现RNA有效载荷的体内特异性细胞递送。
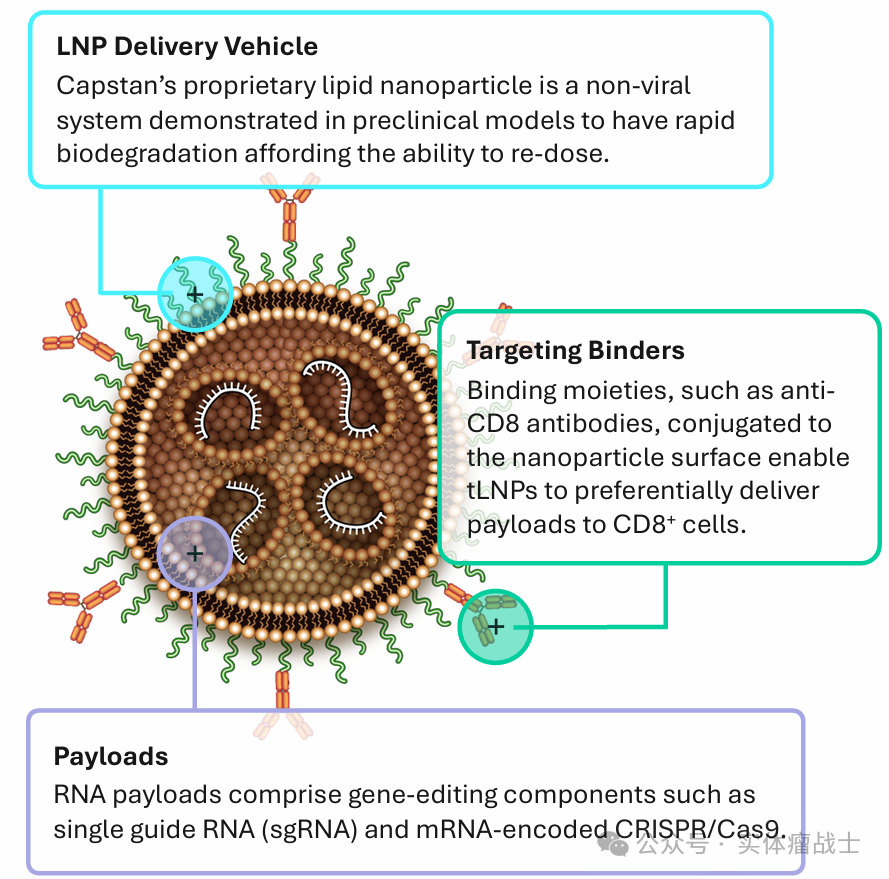
基因编辑有效载荷
- PROGRAM LIST -
分别封装
编码Cas9的mRNA与靶向T细胞受体α恒定区(TRAC)的sgRNA分别封装(单组分载荷)
- PROGRAM LIST -
共同封装
两者共同封装(复合载荷)
tLNPs通过两种抗体实现靶向递送:抗CD5抗体靶向泛T细胞/抗CD8抗体靶向T细胞亚群(注:本研究所述剂量均指RNA总量)
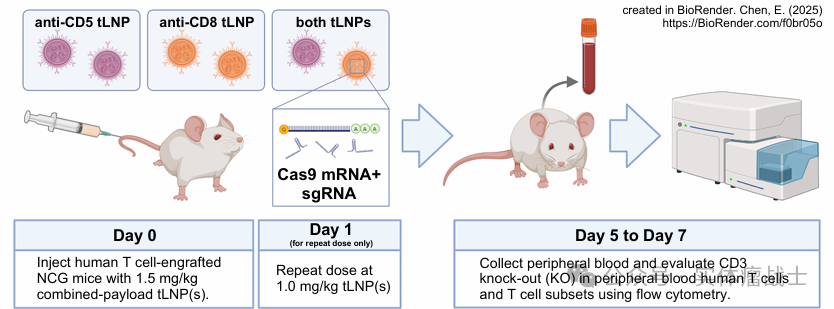
实验方案
- PROGRAM LIST -
体外实验
将单组分/复合载荷tLNPs转染至原代人T细胞
- PROGRAM LIST -
体内实验
通过静脉注射(IV)给药至移植人源T细胞的NCG小鼠(原代T细胞分离自人白细胞单采样本,经CD3/CD28磁珠激活后实施tLNP转染)
定量评估
采用流式细胞术定量评估:体外培养T细胞的基因编辑效率和体内环境中的基因编辑效率
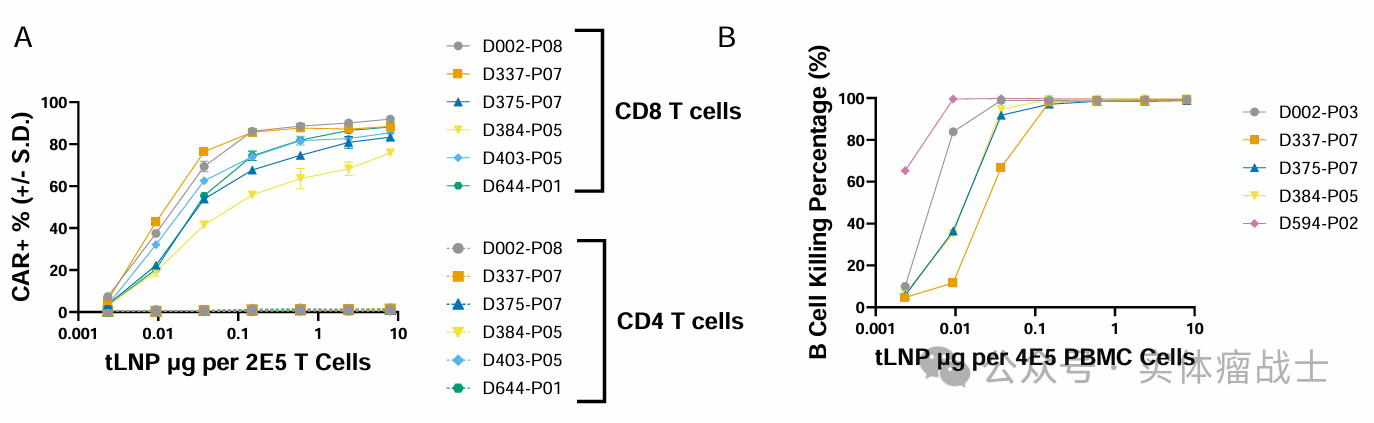
显示未经激活的人源T细胞在体外经CPTX2309转染24小时后的CAR表达百分比。总之CPTX2309可在非激活状态下实现T细胞高效转导,并介导显著的特异性杀伤效应。
总结
mRNA技术在药物递送上为体内CART提供了更好的机会,Capstan Therapeutics是标准的高校技术成果转化企业,且做的都是教授自己的方向,没有出现跨方向的现象,虽然适应症保守,但是确实在为投资人省钱了。
总比没产品上市就要开发跨技术方向的临床药物的部分药企好多了,可能投资人的钱已经多到可以嘎嘎造的水平了。
侃侃而谈
最近斯微生物的破产清算工作正在进行。关注公众号的研发和药企人还是不少,我觉得自己还没有特立独行到是唯一一个觉得斯微投资方向不对劲的人。
2021年4月斯微生物宣布上海天慈1号车间投产时,笔者就觉得不对劲。尤其斯微在澳大利亚开了肿瘤疫苗管线后,笔者更是感觉奇怪。不过现在才写自己的感觉免不了有马后炮的感觉。
参考资料
1.https://www.capstantx.com/
2. Backed by five pharma giants and a crew of Penn superstars, a startup uses mRNA to create in vivo CAR-T — with a pro at the helm
3. Efficient In Vivo Gene Editing of T Cells Utilizing Novel Targeted Lipid Nanoparticles

















