肿瘤特异性脂质与非翻译区的双重保障,实现mRNA治疗的安全、精准与高效
PART.01
引言:免疫治疗的希望与挑战
免疫治疗彻底改变了肿瘤治疗的格局,但其疗效常受安全性问题的制约。
一个核心挑战是如何将免疫激活精准限制在肿瘤部位——正常组织中的脱靶效应可能引发严重的免疫相关不良事件(irAEs)。mRNA疗法凭借其卓越的多功能性,为癌症治疗提供了全新思路,然而传统脂质纳米颗粒(LNPs)倾向于在肝脏富集,这为其在肿瘤领域的应用带来了巨大障碍。
如今,发表在《Nature Nanotechnology》上的一项突破性研究为这一困境带来了曙光。Dong等人开发了名为TITUR的肿瘤定制mRNA平台,通过引入肿瘤特异性可电离脂质(TIs)和肿瘤特异性非翻译区(TURs)双重保障机制,实现了治疗蛋白在恶性细胞中的选择性表达,同时避免对健康组织的损伤(图1)。
这种“双开关”设计不仅能安全诱导免疫原性细胞死亡,还能增强免疫检查点抑制剂在耐药肿瘤模型中的疗效,为mRNA癌症治疗开辟了新途径。
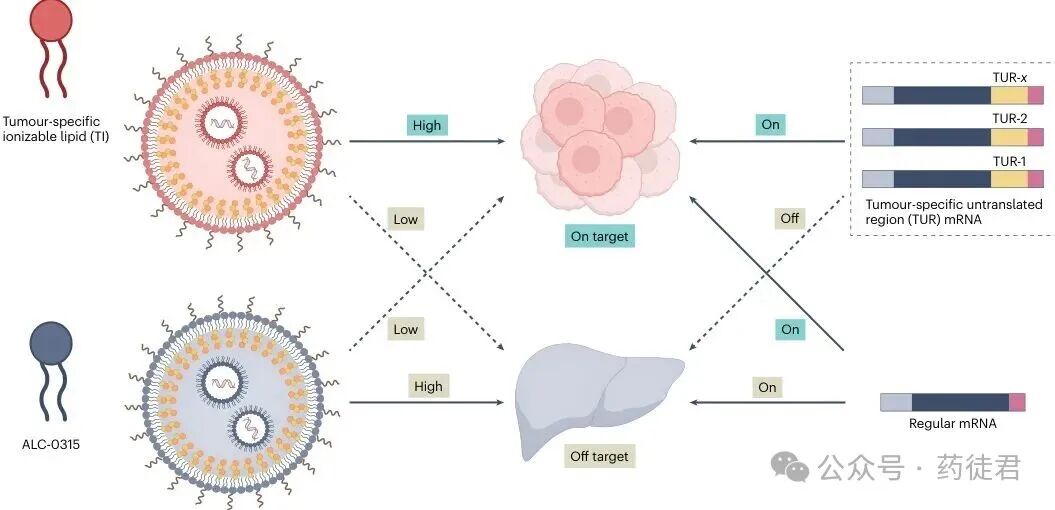
TITUR平台双开关激活肿瘤特异性mRNA治疗示意图
图1 | 双开关激活肿瘤特异性mRNA治疗。TITUR平台采用两种保障机制实现mRNA在肿瘤中的选择性表达。左:具有优化pKa值的肿瘤特异性可电离脂质(TIs)是新设计的载体,优先促进肿瘤细胞中的内体逃逸和后续mRNA表达。相比之下,传统脂质如ALC-0315(辉瑞-BioNTech COVID-19 mRNA疫苗中使用的基准可电离脂质)主要引导肝脏中的表达。右:肿瘤特异性非翻译区(TURs)被整合到mRNA序列中,以利用microRNA谱的差异。在健康组织中,丰富的microRNAs结合TUR基序并沉默翻译,而在肿瘤中,这些microRNAs的缺失允许强大的蛋白质生产。这两个开关共同将蛋白质表达限制在恶性细胞中,在肿瘤内实现有效的免疫激活,同时最大限度地减少全身毒性。
PART.02
mRNA肿瘤治疗的瓶颈:精准递送的挑战
LNPs已被优化用于向各种器官和组织(包括肝脏、肺、脾脏和骨髓)递送mRNA,这些成功反映了脂质化学如何被调节以影响生物分布和摄取。然而,当应用于肿瘤时,器官特异性靶向的成功无法复制。肿瘤异质性和血管化不良阻碍了mRNA-LNP在恶性细胞中的高效递送和表达。
核心挑战:治疗性mRNA编码的抗癌蛋白通常具有高度活性,其在肿瘤外的表达可能导致严重的全身细胞因子释放或肝毒性。因此,实现肿瘤选择性表达是推进mRNA基癌症治疗的根本瓶颈。
PART.03
TITUR平台:双重保障机制的创新设计
Dong及其同事为解决这一挑战,实施了两层保障系统。
这种“内外双开关”设计从递送和表达两个层面确保了治疗的精准性,代表了mRNA治疗领域的重大创新。
外开关:肿瘤特异性可电离脂质(TIs)——化学层面的精准递送
第一个保障是化学层面的:研究团队合成了一个TIs库,并在癌细胞和原代肝细胞中进行筛选。可电离脂质是LNPs的关键组成部分,一旦颗粒被内化,它们能够实现内体逃逸。通过调整头部基团化学和疏水尾部,作者鉴定出在肿瘤细胞的酸性内体中有利于逃逸,而在肝细胞中相对不活跃的TIs。
这种“外开关”使mRNA递送偏向恶性细胞,减少了肝脏中的脱靶暴露。
与传统LNPs(如辉瑞-BioNTech疫苗中使用的ALC-0315)相比,TIs显著改变了递送谱——从肝脏偏向转变为肿瘤偏向,这是肿瘤治疗中的关键突破。
内开关:肿瘤特异性非翻译区(TURs)——RNA层面的表达调控
第二个保障在于RNA本身。TITUR进一步将TURs整合到mRNA中,这是被microRNAs识别的短序列。microRNAs通过结合靶转录本中的互补基序,充当天然的转录后沉默子。重要的是,它们的表达模式在正常组织和肿瘤之间存在差异。
通过嵌入在健康器官中丰富但在癌症中稀缺的microRNAs识别的基序,TUR确保任何到达非恶性细胞的转录本都将被降解或沉默。在缺乏这些microRNAs的肿瘤细胞中,mRNAs被高效翻译。这种“内开关”通过将表达限制在恶性组织中,提供了额外的保护层。
协同效应:双开关的放大作用
值得强调的是,这两个保障措施不是简单叠加,而是协同作用,显著提高了mRNA基癌症治疗的精度。外开关(TIs)减少了递送到正常组织的mRNA量,而内开关(TURs)则沉默了任何侥幸逃脱外开关控制的mRNA。
这种双重保险机制极大地降低了脱靶效应风险,为安全使用强效治疗蛋白铺平了道路。
PART.04
实战验证:MLKL necroptosis mRNA的精准递送
为了证明该平台的效能,作者选择了一个特别严格的治疗载荷:递送编码坏死性凋亡效应因子混合谱系激酶结构域样假激酶(MLKL)的mRNA。这一选择极具挑战性,因为坏死性凋亡的强大免疫激活特性同时带来了巨大的安全风险,完美测试了TITUR平台的保障能力。
Necroptosis:双刃剑般的治疗潜力
Necroptosis是一种不同于凋亡的炎症性细胞死亡形式。与通常具有免疫沉默性的凋亡不同,坏死性凋亡导致损伤相关分子模式(如ATP、HMGB1和钙网蛋白)的释放。这些信号 alert 树突状细胞,启动T细胞反应,触发强烈的免疫激活,并能将免疫“冷”肿瘤转化为“热”肿瘤[2]。
然而,同样的效力也使坏死性凋亡具有危险性:如果在正常器官中触发,它可能引发炎症级联反应、全身细胞因子释放和多器官irAEs。因此,TITUR为这种强大的载荷提供了理想的保障框架。
临床前研究结果: efficacy与安全性的完美平衡
在黑色素瘤和三阴性乳腺癌的小鼠模型中,TITUR介导的MLKL表达在肿瘤内选择性诱导了强大的坏死性凋亡,促进了树突状细胞和T淋巴细胞的浸润,并使肿瘤对抗PD-1检查点阻断敏感。
疗效突破:令人惊讶的是,对免疫治疗耐药的肿瘤被转化为响应性肿瘤,同时抑制了原发和转移性生长。
疫苗效应:治疗的动物还表现出对肿瘤再挑战的保护作用,模拟了原位癌症疫苗的效果。
安全性优势:与传统LNPs不同,TITUR没有引起体重减轻、肝损伤或全身炎症,强调了双重保障的重要性。
这些结果证实,TITUR平台成功解决了强效免疫治疗剂的“效能-安全”悖论,为将其他高风险、高回报的治疗分子应用于临床开辟了道路。
PART.05
平台优势与潜在应用:模块化设计的广泛前景
这些发现不仅突出了疗效,还展示了平台的模块化优势。
TITUR的设计灵活性使其有望成为多种癌症和多种治疗分子的通用平台。
模块化设计:适应不同肿瘤类型的定制化治疗
TI脂质可以针对不同的肿瘤类型进行定制,而TUR基序可以适应特定癌症特征的microRNA特征。
这种模块化设计意味着:
肿瘤类型适应性:通过调整TI脂质的化学结构,可以优化对不同肿瘤微环境的靶向性。
患者个体化治疗:基于患者肿瘤的microRNA谱,选择相应的TUR基序,实现真正意义上的个体化医疗。
治疗载荷多样性:平台可用于递送各种治疗蛋白,而非仅限于MLKL。
潜在应用扩展:超越necroptosis的广泛可能性
TITUR原则上可应用于necroptosis之外的其他治疗蛋白,包括:
细胞因子:如IL-2、IFN-γ等,这些分子在肿瘤微环境中可强力激活免疫反应,但全身给药毒性大。
基因组编辑器:如CRISPR-Cas9系统,精准递送可减少脱靶编辑风险。
肿瘤抑制因子:如p53等,其在正常细胞中的过表达可能导致毒性。
免疫检查点调节剂:如抗CTLA-4、抗PD-L1等,局部表达可提高肿瘤内浓度同时减少全身副作用。
这种广泛的适用性使TITUR平台成为肿瘤治疗领域的“瑞士军刀”,有望在多个方向推动癌症治疗的进步。
PART.06
挑战与展望:从实验室到临床的道路
尽管TITUR平台展现出巨大潜力,但从实验室研究到临床应用仍面临若干挑战,需要研究人员和临床医生共同努力克服。
当前挑战:肿瘤异质性与个体化差异
脂质性能的肿瘤特异性差异:脂质性能在不同癌症模型中有所不同,这意味着可能需要针对每种适应症进行肿瘤特异性筛选,以确定最佳配方。
microRNA表达的异质性:microRNA表达不仅在患者之间,而且在个体肿瘤类型内都显示出显著的异质性,这增加了TUR设计和应用的复杂性。
肿瘤微环境的复杂性:实体瘤的复杂微环境(如基质纤维化、免疫抑制细胞浸润)可能影响TITUR的递送效率。
未来研究方向:优化与创新
为了推动TITUR平台的临床转化,未来研究应关注以下方向:
脂质化学的进一步优化:开发具有更广泛肿瘤适用性或针对特定肿瘤类型的新一代TIs。
多靶点TUR设计:整合多个microRNA结合位点,以应对肿瘤内microRNA表达的异质性。
联合治疗策略:探索TITUR与化疗、放疗、免疫治疗等其他疗法的协同效应。
临床前大动物模型验证:在更接近人类生理条件的大型动物模型中评估安全性和有效性。
递送系统的改进:结合主动靶向策略(如抗体修饰)进一步提高递送效率。
展望未来:TITUR代表了精准mRNA治疗的概念性进展。
通过在纳米颗粒和载荷水平整合保障措施,Dong及其同事证明,将强效免疫激活限制在肿瘤内同时最小化全身风险是可能的。这种双开关策略为下一代mRNA LNPs建立了蓝图,超越肝脏趋向性,为安全有效的癌症免疫治疗开辟了道路。
PART.07
结语:精准肿瘤治疗的新时代
TITUR平台的开发是mRNA肿瘤治疗领域的一个里程碑。
通过创新性地结合肿瘤特异性可电离脂质和非翻译区,研究人员成功解决了长期困扰该领域的精准递送和安全性问题。这一“双开关”设计不仅在临床前模型中展现出卓越的疗效和安全性,其模块化特性还为未来开发多种癌症、多种治疗分子的个性化治疗方案奠定了基础。
虽然从实验室到临床应用仍面临挑战,但TITUR平台无疑为癌症治疗开辟了新的方向。它不仅是一项技术创新,更代表了一种治疗理念的转变——从“地毯式轰炸”到“精准靶向”,从“疗效优先”到“疗效与安全并重”。随着研究的深入和技术的完善,我们有理由相信,TITUR及类似平台将在未来的肿瘤治疗中发挥越来越重要的作用,为癌症患者带来新的希望。
PART.08
参考资料
Luo Z, Mitchell MJ. Dual switches ignite tumour-specific mRNA therapeutics. Nat Nanotechnol. 2025;20(12):1725-1726. DOI:10.1038/s41565-025-02047-3.

















